非金属性:Cl>Br
参考答案:(每空2分,共8分)
实验方案
(只填写选用试剂序号)
实验现象
结论
⑴
?③ ④ ⑤? ? ?
一支试管中有白色沉淀生成,另一支试管中先生成白色沉淀,后白色沉淀消失
金属性: Mg>Al?
⑵
?⑥⑧?
?溶液由无色变为黄色(或橙黄)?
非金属性:Cl>Br
本题解析:略
本题难度:一般
2、填空题 某同学查阅资料得知,①草酸晶体(H2C2O4·2H2O)在175℃时受热分解,同时熔化且熔融时易挥发。②草酸晶体易溶于水,而草酸钙难溶于水。
为验证草酸分解的产物,该同学选择如下仪器和试剂中的部分完成此实验。
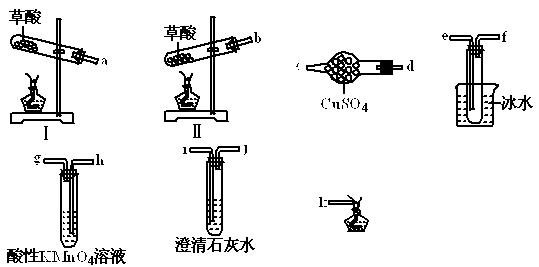
(1)草酸晶体受热分解的方程式为?。
(2)草酸晶体受热分解时,选择的装置为?,理由是?。
(3)若只验证CO2气体一种产物时,除气体发生装置外所选择装置的接口顺序为?。
(4)若验证所有的产物时,除气体发生装置外所选择的必要装置的接口顺序为?。
(5)草酸晶体使酸性高锰酸钾溶液褪色的化学方程式为?。
参考答案:⑴ 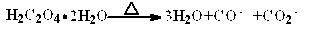 (3分) (3分)
⑵Ⅱ(1分);草酸熔沸点低,在分解之前就熔化或气化,所以必须选择试管口比试管底高的装置。(2 分)⑶e,f,i,j,k(3分)⑷d,c,i,j,h,g,k(3分)
⑸2KMnO4+5HOOCCOOH·2H2O+3H2SO4=2MnSO4+K2SO4+10CO2↑+10H2O(3分)
本题解析:略
本题难度:一般
3、实验题 某教师在课堂上用下图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质。请回答下列问题:

①通过试管乙中发生的 ? ? 现象说明了铜和浓硫酸发生了化学反应,并且该现象还能说明产生的气体具有 性。
②写出试管甲中所发生反应的化学方程式 。
③该反应体现了浓硫酸的?性和?性。
参考答案:①品红溶液褪色;漂白;② Cu +? 2H2SO4 (浓)?△CuSO4 +? SO2?+ 2H2O?③氧化,酸性
本题解析:①通过试管乙中发生的品红溶液褪色现象说明了铜和浓硫酸发生了化学反应,并且该现象还能说明产生的气体具有漂白性。
②试管甲中所发生反应的化学方程式:Cu +? 2H2SO4 (浓)?△CuSO4 +? SO2 ↑+ 2H2O
③该反应体现了浓硫酸的酸性和漂白性。
本题难度:一般
4、实验题 (13分)I.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
(NH4)2S2O8和KI反应的离子方程式为:S2O82-+ 2I-= 2SO42-+ I2?(1)
平均反应速率的计算式为v(S2O82-)=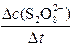 。 。
实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌。
在反应(1)进行的同时,发生反应:2S2O32-+ I2 ="?" S4O62-+ 2I-?(2)
反应(1)生成的I2立即与S2O32-反应,生成无色的S4O62-和I-。S2O32-耗尽时,反应(1)继续生成的I2才与淀粉作用呈现蓝色。从加入(NH4)2S2O8溶液到出现蓝色的时间为Δt。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
实?验?编?号
| ①
| ②
| ③
| ④
| ⑤
| ?
试剂
用量
(mL)
| 0.20? mol·L-1(NH4)2S2O8溶液
| 20.0
| 10.0
| ?b
| 20.0
| 20.0
| 0.20? mol·L-1 KI溶液
| 20.0
| 20.0
| 20.0
| 10.0
| 5.0
| 0.010? mol·L-1 Na2S2O3溶液
| ?a
| 8.0
| 8.0
| 8.0
| 8.0
| 0.2% 淀粉溶液
| 2.0
| 2.0
| 2.0
| 2.0
| 2.0
| 0.20? mol·L-1KNO3溶液
| 0
| 0
| 0
| 10.0
| ?c
| 0.20? mol·L-1(NH4)2SO4溶液
| 0
| 10.0
| 15.0
| 0
| 0
| 20 ℃时,反应时间Δt(s)
| 32
| 67
| 130
| 66
| 135
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变
|
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是?。
(3)第①组实验的v(S2O82-)=?mol·(L·s)-1。
(4)根据上表数据分析,可以得到的结论有(写出一条即可)?
?。
II.实验小组查资料得知,向含有Na2CO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:Na2CO3 + SO2= Na2SO3 + CO2;2Na2S + 3SO2 = 2Na2SO3 + 3S↓;
Na2SO3 + S= Na2S2O3。该小组根据上述原理设计下图所示装置制备Na2S2O3。
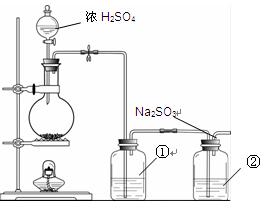
(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是
①?;
②?。
(2)实验过程中,随着气体的通入,装置①中有气泡产生,还有大量黄色固体析出,继续通入气体,可以观察到的现象是?。
(3)反应结束后,从制得的Na2S2O3稀溶液中得到Na2S2O3·5H2O晶体的主要操作包括:?。
参考答案:(13分)
I(1)a? 8.0?(1分)? b? 5.0?(1分)? c? 15.0?(1分)
(2)搅拌?(1分)?(3)2.5 × 10-5?(2分)(4)反应物浓度增大反应速率加快;反应速率变化和反应物起始浓度变化存在比例关系;反应物浓度对反应速率的影响和化学计量数无关等(只答浓度对化学反应速率有影响不给分)?(1分)
II(1)①Na2S溶液、Na2CO3溶液(2分)②NaOH溶液…(不写溶液不得分)(1分)
(2)沉淀逐渐消失?(1分)?(3)加热浓缩,冷却结晶,过滤(2分)
本题解析:略
本题难度:简单
5、实验题 (18分)某中学高一课外兴趣小组为探究铜跟硫酸的反应情况,设计了如图所示装置进行有关实验。

(1)先关闭活塞a,将6.4g铜片和12 mL某浓度的浓硫酸放在圆底烧瓶中共热至反应完毕,发现烧瓶中还有铜片剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中烧瓶内发生的化学方程式:关闭活塞a?;
打开活塞a?;
②B是用来收集实验中产生的气体的装置,但导管未画全,请在上图中把导管补充完整;
③实验结束后,装置C中的溶液中可能含有的溶质有?。
(2)该小组甲同学对“如何检验SO2中混有少许CO2”这个问题很感兴趣,他将A中铜片换作木炭粉,并在A、B之间连接了如下装置:

试剂:a. NaOH溶液? b. 品红溶液? c. 酸性KMnO4溶液? d. Ca(OH)2溶液
请回答:
①该同学的实验装置A中发生的化学方程式? ?。 ?。
②若要达到此目的,可以在:(填所提供试剂编号)
D中加入?;E中加入?;F中加入?。
(3)事实证实,第(1)问铜片完全消失后,硫酸仍有剩余,乙同学欲测定余酸的物质的量浓度,假设反应前后溶液体积变化忽略不计,他向反应后溶液中加入含溶质a mol 的NaOH溶液刚好使溶液中Cu2+全部沉淀。据此,他能求出余酸的物质的量浓度吗?若能,请写出余酸物质的量浓度的表达式:?mol/L( 的NaOH溶液刚好使溶液中Cu2+全部沉淀。据此,他能求出余酸的物质的量浓度吗?若能,请写出余酸物质的量浓度的表达式:?mol/L( 用含a的代数式表达,若不能,该空不填)。 用含a的代数式表达,若不能,该空不填)。
参考答案:
(1)①Cu+2H2SO4(浓)  CuSO4+SO2?+2H2O;(2分) CuSO4+SO2?+2H2O;(2分)
2Cu+O2+2H2SO4 2CuSO4+2H2O (2分 2CuSO4+2H2O (2分 ) )
(或分步写成:2Cu+O2=2CuO;CuO+H2SO4=CuSO4+H2O,也可)
②
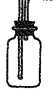 ? (2分) ? (2分)
③NaOH? Na2SO3? Na2SO4?(3分)
(2)①C+2H2SO4(浓) ?CO2?+2SO2?+2H2O?(3分) ?CO2?+2SO2?+2H2O?(3分)
②? c? b? d?(3分)
(3)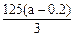 ?(3分,其余合理表达式均可) ?(3分,其余合理表达式均可)
本题解析:略
本题难度:简单
|