1、填空题 为了制得氯气并探究氯气的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中。试回答:
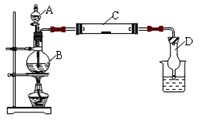
(1)怎样检验装置的气密性??;
(2)若C中为淀粉KI试纸,实验片刻后C中可以观察到的实验现象为?;写出
B中发生反应的离子方程式?。
(3)若C中的淀粉KI试纸实验一段时间后又变为无色,原因是?。
(4)D的作用是_______________。烧杯中加入的是??。
(5)若实验室暂时无二氧化锰,仍用此装置制取氯气,选用?药品替代。若实验室暂时无浓盐酸,仍用此装置制取氯气,选用?药品替代。
参考答案:(12分)(1)关闭分液漏斗,对烧瓶进行微热,看烧杯中是否有气泡产生,冷却后D中是否产生水柱。(2分)
(2)试纸变蓝色(1分)。MnO2 +2Cl- +4H+ ? ?Mn2+? +Cl2↑ +2H2O(2分)
?Mn2+? +Cl2↑ +2H2O(2分)
(3)将KI氧化成KIO3 (2分)
(4)防倒吸(1分)氢氧化钠溶液(1分)
(5)KMnO4、KClO3(合理 给分)(2分);NaCl和浓硫酸(1分)
给分)(2分);NaCl和浓硫酸(1分)
本题解析:略
本题难度:一般
2、实验题 (20分)实验题
Ⅰ以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
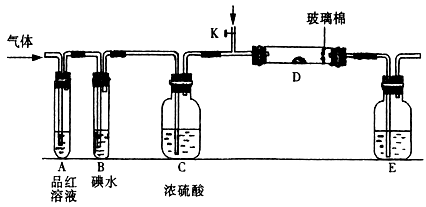
若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同??(填“相同”或“不相同”);若装置D中装的是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为?。
②SO2通入B中,溶液颜色退去,则该反应的离子方程式为?。
(2) 某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母)?,仍然无法观察到沉淀产生。
A.氨水? B.稀盐酸? C.硝酸钾溶液? D.硫化钠溶液
(3)若由元素S和O组成–2价酸根离子X,X中S和O的质量比为2∶3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式?。?
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如图
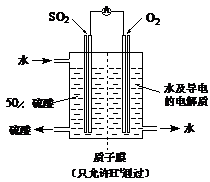
含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入SO2的电极为_________极,其电极反应式为?;电池的总反应式?
Ⅱ实验是化学研究的基础,关于下列各装置图的叙述正确的是?(填序号)
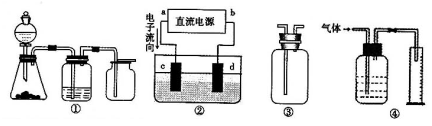
A.装置①可完成多种气体的发生、净化和收集,如铜屑与稀硝酸反应
B.装置②中,a为正极,d为阳极
C.装置③可用于收集H2、NH3、Cl2,、HCl、NO2等
D.装置④能用于测量气体体积
Ⅲ?用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中正确的是?(填序号)
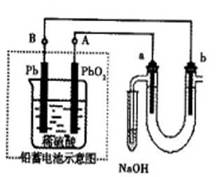
A.铅蓄电池负极的反应式为:Pb—2e-=Pb2+
B.铅蓄电池放电时,B极质量减轻,A极质量增加
C.铅蓄电池充电时,A极应与外电源负极相连
D.电解苦卤水时,a电极首先放电的是Br-
参考答案:Ⅰ (1) ①相同? 2SO2 + O2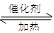 2SO3
2SO3
②SO2 + I2 + 2H2O = 4H++ 2I-+ SO42-?
(2) B
(3) Cl2 + SO32-+H2O = SO42-+ 2Cl-+ 2H+
(4) 负? SO2 – 2e-+ 2H2O = 4H++ SO42-? 2SO2 + O2 + 2H2O = 2H2SO4
Ⅱ C
Ⅲ? D
本题解析:(1)①由于SO2和Cl2都可以使品红溶液褪色,所以A中分别通入SO2和Cl2,观察到的现象是相同的。
若装置D中装的是五氧化二钒(催化剂),通入SO2时,打开K通入适量O2,则发生SO2的催化氧化,反应方程式为2SO2 + O2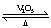 2SO3。
2SO3。
②SO2通入B中,碘水褪色,并不是SO2的漂白作用,而是SO2还原碘为无色的物质,离子方程式为:SO2 + I2 + 2H2O = 4H++ 2I-+ SO42-
(2)SO2通入装有氯化钡溶液,它只与水生成亚硫酸,得到酸性溶液,但与氯化钡是不发生化学反应的(弱酸不能制强酸),无沉淀生成;
A:加入氨水,可得到SO3—,进而生成沉淀:SO3—+Ba2+=BaSO3↓
B:加入稀盐酸,无反应发生,符合题意
C:在酸性情况下,NO3—具有强氧化性,可将SO3—氧化为SO42—,进而得到BaSO4沉淀
D:在酸性情况下,+4价硫与—2价硫发生归中反应,生成浅黄色沉淀硫
(3)由S和O的质量比为2∶3可知,两元素的个数比为1:3,即X为SO32-,此离子被被氧化成SO42-,离子方程式为:Cl2 + SO32-+H2O = SO42-+ 2Cl-+ 2H+
(4)此装置为原电池,原电池的正极发生还原反应,负极发生氧化反应,所以氧气得电子为正极:O2+4e-+4H+=2H2O;总反应为:2SO2 + O2 + 2H2O = 2H2SO4;
由总反应减去负极反应可得负极电极反应为:SO2 – 2e-+ 2H2O = 4H++ SO42-
Ⅱ、A.铜屑与稀硝酸在加热条件下才可反应,不正确
B.a极流出电子,为负极,不正确
C.各气体均不与空气反应,通过改变进出口分别采用向上或向下排气法来收集,正确
D.由于进气导管长,而出气导管短,故不能排出液体,不正确
Ⅲ、A.铅蓄电池负极的反应式为:Pb—2e-+SO42—=PbSO4
B.铅蓄电池放电时,Pb或PbO2均转变为PbSO4,两极质量均增加,不正确
C.铅蓄电池A极为电池正极,充电时应与外电源正极相连
D.a极为阳极,阴离子放电,根据放电顺序可知,首先放电的是Br-,正确
故选D
本题难度:简单
3、填空题 室温下,将一定浓度的Na2CO3溶液滴入CnSO4溶液中得到了蓝色沉淀。为了确定沉淀的组成,某研究性学习小组进行了以下试验和研究。
(一)【提出假说】
假设一:两者反应只生成CuCO3—种沉淀;
假设二:这两者祁互促进水解,生成Cu(OH)2—种沉淀,则此反应化学方程式为:____________________________;
假设三:生成的是CuCO3和Cu(OH)2两种沉淀。
(二)【理论探究】
查阅资料:CuCO3, Cu(OH)2均不带结晶水;
Cu(OH)2均不带结晶水;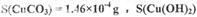
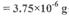 ;若由此数据判断,假设_______是不正确的。
;若由此数据判断,假设_______是不正确的。
(三)[实验探究]
步滋一:将CuCO4溶液倒入等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成。
步骤二:将沉淀从溶液中分离出来,其操作方法为:①过滤,②_______,③干燥。
步骤三:利用下图所示装置,进行定量分析:
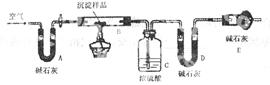
①仪器组装好后首先要进行的实验操作是_____________________。
②实验结束时通入过量空气的作用是_____________________。
③数据记录和分析:实验过程中测定的数据有:W1——样品的质量;W2——反应后装置B中残渣的质量;W3——反应生成的水的质量;W4——反应后生成二氧化碳的质量,为了测定其组成,至少需要其中? 个数据,请将可能的组合填入下表中(每个空格中填一种组合,有几种组合就填几种,不必填满.)
参考答案:(一)假设二:Na2CO3 +CuSO4 +H2O=Cu(OH)2↓+Na2SO4+CO2↑(3分)
(二)一 (2分)
(三) 步骤二:洗涤(1分)
步骤三:①检查装置的气密性 (2分)
②保证装置中的水蒸气和CO2被C、D装置完全吸收(2分。只要涵义表达清楚即给2分)
③2(2分)
W1W2
W1W3
W1W4
W2W3
W2W4
W3W4
?
?
(每答对2组给1分,不存在0.5分,共3分)
本题解析:略
本题难度:一般
4、实验题 (10分)某探究性学习小组拟用小颗粒状铝硅合金与足量稀硫酸的反应(其中硅与稀硫酸不反应)测定通常状况(约20℃,1 atm)下气体摩尔体积的方法。拟选用下列实验装置完成试验:
(1)该组同学必须选用的装置的连接顺序是(用管口字母,可不填满):
A接(?)(?)接(?)(?)接(?)
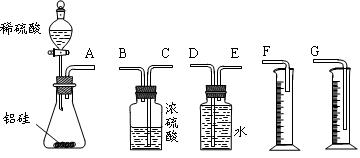
(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因_________________________。
(3)实验结束时,该组同学应怎样测量实验中生成氢气的体积?_______________。
(4)实验中准确测得4个数据:实验前铝硅合金的质量m1 g,实验后残留固体的质量m2 g,实验后量筒中液面读数为VmL。则通常状况下气体摩尔体积Vm=_________。若合金中含铜,测得的Vm将________(偏大/偏小/无影响)。
参考答案:(1)E D G?
(2)铝与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大?
(3)待实验装置冷却后,上下移动量筒使其中液面与广口瓶中液面相平,再平视读取量筒中水的体积,即氢气在通常状况时的体积。(仅答两点给1分)
(4)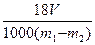 ?L·moL-1?无影响
?L·moL-1?无影响
本题解析:略
本题难度:一般
5、填空题 为了验证镁和铝的金属性强弱,某同学欲设计实验验证.提供的试剂有:镁带、铝条、水、盐酸、浓硫酸.
(1)所选试剂为______;
(2)发生反应的化学方程式为______;
(3)请简要叙述其操作过程及现象______.
参考答案:(1)金属镁和铝和盐酸反应产生氢气的速率不一样,可以证明金属的活泼性强弱,金属铝在常温下遇到浓硫酸发生钝化,不能用浓硫酸,故答案为:镁带、铝条、盐酸;
(2)金属镁和铝与盐酸反应分别为:Mg+2HCl═MgCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑,故答案为:Mg+2HCl═MgCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑;
(3)将镁条和铝带分别放入盛有浓度相等的盐酸溶液中,观察产生氢气的速率,产生氢气的速率快的是金属镁,反之是金属铝,故答案为:将镁条和铝带分别放入盛有浓度相等的盐酸溶液中,观察产生氢气的速率,产生氢气的速率快的是金属镁,反之是金属铝.
本题解析:
本题难度:一般