1、选择题 CS2是一种有恶臭气味的液体,将其滴入用硫酸酸化的KMnO4溶液中时生成单质硫并放出CO2,当生成 0.5 mol CO2时转移电子的物质的量是…(? )
A.1 mol
B.4 mol
C.3 mol
D.2 mol
参考答案:D
本题解析:本题是根据信息判断氧化还原反应中电子转移的数目。由题意可知CS2被氧化生成CO2和S,当生成 0.5 mol CO2时,有0.5 mol CS2被氧化,依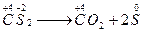 ,可知转移电子的物质的量是2 mol。
,可知转移电子的物质的量是2 mol。
本题难度:简单
2、填空题 天宫一号(Tiangong-1)是中国第一个目标飞行器,于2011年9月29日21时16分3秒在酒泉卫星发射中心发射,它的发射标志着中国迈入中国航天“三步走”战略的第二步。天宫一号是由长征二号大推力火箭发射升空的,火箭推进剂是成功发射火箭的重要因素,推进剂的发展经历了一个漫长的过程。
(1)20世纪前,黑火药是世界上唯一的火箭用推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式为2KNO3+ S + 3C ="=" K2S + N2 ↑+ 3CO2 ↑。
①写出K2S的电子式:?;
②某化学兴趣小组进行了如下实验:
实验一:取适量黑火药溶于水,过滤,将滤液蒸发浓缩,冷却后慢慢 加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,写出该反应的离子方程式:
加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,写出该反应的离子方程式:
?;
实验 二:取黑火药爆炸后的残留固体,加水溶解过滤,取滤液向其中滴加新制氯水至过量,
二:取黑火药爆炸后的残留固体,加水溶解过滤,取滤液向其中滴加新制氯水至过量, 一开始溶液变浑浊后又变澄清。请设计实验方案证明该澄清溶液中含有Cl-:?;
一开始溶液变浑浊后又变澄清。请设计实验方案证明该澄清溶液中含有Cl-:?;
(2) 1947年,研制出第二代聚硫橡胶、高氯酸铵、铝粉复合推进剂。高氯酸铵受撞击会引发剧烈爆炸,其爆炸产物有4种,2种产物是空气中的主要成分,另一种气体产物能使湿润的蓝色石蕊试纸变红,写出该反应的化学方程式:?;
(3)20世纪60年代,美国大推力火箭使用的是液体推进剂,常用的氧化剂有双氧水、四氧化二氮、液氧;可燃物有肼(N2H4)、一甲肼、偏二甲肼、液氢等。火箭发射时将两种液体分别注入火箭发动机的燃烧室中燃烧。偏 二甲肼的系统命名为1,1-二甲基联氨,它的结构简式为?;
二甲肼的系统命名为1,1-二甲基联氨,它的结构简式为?;
(4)以上的火箭推进剂一般都含有氮元素,含氮化合物种类丰富,科学家从化肥厂生产的硫酸铵中检出组成为N4H4(SO4)2的物质,该 物质为易溶于水的强电解质,遇烧碱会生成N4气体,该反应的离子
物质为易溶于水的强电解质,遇烧碱会生成N4气体,该反应的离子 方程式:?;另一含氮化合物N4H4也是易溶于水的强电解质,和烧碱
方程式:?;另一含氮化合物N4H4也是易溶于水的强电解质,和烧碱 反应生成能使湿润的红色石蕊试纸变蓝的气体,而与盐酸反应生成的产物之一具有极强烈的爆炸性,写出该产物爆炸的化学反应方程式:?。
反应生成能使湿润的红色石蕊试纸变蓝的气体,而与盐酸反应生成的产物之一具有极强烈的爆炸性,写出该产物爆炸的化学反应方程式:?。
参考答案:(14分)
(1)①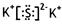 ;(1分)
;(1分)
②实验一: Cu+4H++2NO3— ?Cu2++2NO2 ↑+2H2O?(2分)
?Cu2++2NO2 ↑+2H2O?(2分)
实验二:取适量澄清液,加入过量的硝酸钡溶液,静置,取上层清液,滴入硝酸酸化的硝酸银,若出现白色沉淀,证明有Cl—(3分)
(2)4NH4ClO4 ?2N2↑+5O2↑+4HCl↑+6H2O↑(2分)
?2N2↑+5O2↑+4HCl↑+6H2O↑(2分)
(3) (CH3)2NNH2(2分)
(4)N4H44++4OH— N4↑+4H2O (2分)
N4↑+4H2O (2分)
2HN3 H2↑+3N2↑(2分)
H2↑+3N2↑(2分)
本题解析:略
本题难度:一般
3、选择题 下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是
[? ]
A.2Na + 2H2O ==2NaOH + H2↑
B.CH4 + 2O2==CO2 + 2H2O
C.KClO3==2KCl + 3O2↑
D.CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
参考答案:B
本题解析:
本题难度:简单
4、实验题 二氧化氮(NO2)是一种具有高度活性的气态物质,NO2与Na2O2均具有较强的氧化性,某研究性学习小组对二者能否发生反应进行探究。
【实验】
下列关于实验室制备NO2的说法正确的是_______
a.实验室常用铜和浓硝酸反应制取二氧化氮
b.二氧化氮常用向下排空气法收集
c.二氧化氮易溶于水,尾气可用水吸收.
d.用注射器收集的二氧化氮,压缩后颜色变浅
e.实验后容器中残留液需用碱液处理
【提出假设】
假设一:NO2与Na2O2二者不反应;
假设二:NO2能被Na2O2氧化;
假设三:?
【查阅文献】
NO2在反应中能生成HNO3和HNO2;HNO2旣有氧化性,又有还原性,能被强氧化剂如KMnO4氧化。
【设计实验】
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设?不成立。
(2)若假设二成立,反应的化学方程式是?。
(3)为验证假设二是否成立,该小组同学做了如下定性实验研究,请完成下表内容。
实验步骤
(不要求写具体操作过程,仪器任选)
| 预期的实验现象及结论
|
取适量的白色固体置于试管中,…………
| ?
|
?
【定量分析】
若实验前该小组同学用托盘天平称量过氧化钠的质量为3.9g,充分反应后白色固体质量为8.4g,该小组同学得出假设2不成立的结论。你是否同意他们的结论,并简述理由:?
参考答案:(共13分)
【实验】a e(2分)?
【提出假设】假设三:NO2能被Na2O2还原(2分)
【设计实验】 (1)一(1分)
(2)2NO2 + Na2O2 = 2NaNO3(2分,不配平不得分)
(3)(4分)
实验步骤(不要求写具体操作过程)
预期的实验现象及结论
取适量的白色固体置于试管中,加蒸馏水溶解,再滴加稀硫酸酸化,最后滴加高锰酸钾溶液。
若高锰酸钾溶液不褪色,则假设2成立;若高锰酸钾溶液褪色,则假设2不成立。(其他合理答案也可)
?
(4)(2分)不同意。若3.9 g过氧化钠全部氧化二氧化氮,生成NaNO3的质量应该为8.5 g,而现在测量的质量为8.4 g,质量相差不大,在托盘天平称量的误差范围之内,这完全有可能为实验误差引起。
(同意。若3.9 g过氧化钠全部氧化二氧化氮,生成的NaNO3的质量应该为8.5 g,而现在测量的质量为8.4 g<8.5 g。注:本题为开放性答案,其它合理答案也可)
本题解析:
【实验】考查NO2的制备,a、Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,正确;b、NO2能与水发生反应,故不能使用排水法收集,错误;c、溶于水后生成NO,同样是污染,错误;d、压缩后虽有部分转化为N2O4,但NO2的浓度增大,颜色加深,错误;e、残液为酸性,故用碱处理,正确。
【提出假设】根据情况,不反应、反应被氧化,另外为反应被还原;
【设计实验】
(1)用淡黄色变为白色,说明过氧化钠反应,假设一错误
(2)假设二成立,NO2被Na2O2氧化,即氮的化合价升高从+4到+5,O从-1到-2,然后配平即得到答案。
(3)关键是对产物的检验,硝酸根的检验方法。
本题难度:一般
5、填空题 市面上消毒剂、漂白剂的种类繁多。
(1)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是?。(填序号)
a.MnO2?b.KMnO4溶液? c.稀盐酸 ? d.Na2SO3溶液
(2)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,会发生如下的分解,配平反应的离子方程式,并用单线桥标出电子转移的方向和数目:
?HClO2 ——?ClO2↑+?H+ +?Cl-+?H2O
该反应中氧化剂与还原剂的质量之比为:?。若有标准状况下11.2 L的ClO2生成,则转移的电子数是?。
(3)氧化物X是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由NaClO3和Na2SO3按物质的量比2:1,并在H2SO4存在的条件下加热制得,则X为?, 请写出相应的离子方程式?。
参考答案:(1)b(2)(5,4,1,1,2);1:4;3.01×1023:5HClO2;
(3)ClO2 , 2ClO3-+ SO32-+2H+△2ClO2↑+ SO42-+2H2O
本题解析:略
本题难度:一般