| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《影响化学反应速率的因素》在线测试(2019年最新版)(二)
参考答案:B 本题解析:A、增大一氧化碳浓度,正反应速率增大,故A正确;B、增大反应物浓度,正反应速率增大,逆反应速率开始不变,然后逐渐增大,故B错误;C、达到平衡状态,生成物浓度比原先增大,导致逆反应速率比原平衡大,故C正确;D、由于温度不变,化学平衡常数不变,故D正确。 本题难度:一般 3、实验题 (13分)Ⅰ.某学校研究性学习小组开展“不同条件对化学反应速率影响的探究”课题,选用4 mL 0.01 mol·L-1KMnO4溶液与2 mL 0.1 mol·L-1 H2C2O4溶液进行实验,改变条件如下:
(2)对比实验①和④,可以研究 对化学反应速率的影响,实验④中加入1 mL蒸馏水的目的是 。 Ⅱ.该小组查阅资料得知:C2O42-+MnO4-+H+→ CO2↑+Mn2++H2O(未配平),欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数。该小组称量1.34 g草酸钠样品溶于稀硫酸中,然后用0.200 mol·L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应)。 (1)滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。 (2)滴定时用 (填a或b)滴定管盛装KMnO4标准溶液。 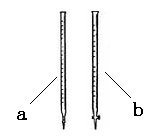 (3)达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为 。 参考答案:Ⅰ.(1)①和② (1分) ; ①和③ (1分) 本题解析:Ⅰ.(1)要研究催化剂对化学反应速率的影响,则其它条件应该是相同的,所以应该用实验①和②。同样要研究温度对化学反应速率的影响,其它条件也应该是相同的,所以应该用实验①和③。 本题难度:困难 4、填空题 (16分) 已知2A2(g)+B2(g) 参考答案:27.((1)(2)每空1分,其余每空2分,共16分) 本题解析:(1)热化学方程式表达的意义为:当2mol A2和1mol B2完全反应时,放出热量为akJ,而加入2mol A2和1mol B2达到平衡时,没有完全反应,即释放的热量小于完全反应释放的热量,即b<a,(2)常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,正反应方向放热,升高温度,化学平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,K减小,若将反应容器的体积压缩,即增大压强,平衡向正反应方向移动,因为影响化学平衡常数的因素只有温度,所以该反应的平衡常数不变。(3)相同条件下,2mol C3达到平衡状态时,与加入2mol A2和1mol B2建立完全相同的平衡状态,即等效平衡,C3="w" mol/L,即从化学平衡状态到完全反应生成2molC,放出热量为c kJ,由于等效平衡的正逆反应转化率之和等于1,则b+c=a,C=a-b,(4)2v逆(A2)=v正(B2),表示的是正逆反应速率,但是不满足化学计量数的关系,正逆反应速率不相等,没有达到平衡状态,A错误;反应中表示的都是正反应速率,无法判断正逆反应速率是否相等,B错误;A2与C3浓度相等,应该是浓度保持不变,C错误;混合气体的平均相对分子质量=m/n,随着反应的进行,气体的物质的量逐渐减小, 混合气体的平均相对分子质量不变,说明达到平衡,D正确;由于反应两边气体的分子数发生改变,反应中压强改变,所以压强不变能判断反应是否达到了平衡状态,E正确;反应方程式两边气体的质量相等,容器的容积固体,根据密度ρ=m/v,可见密度是个常量,始终都不发生变化,F错误。(5)为使该反应的反应速率增大,可以B.适当升高温度C.增大B2的浓度D.选择高效的催化剂,为使平衡向正反应方向移动,可以A.及时分离出C3气体C.增大B2的浓度,综上所述为使该反应的反应速率增大,且平衡向正反应方向移动的是C。(6)由于给定反应是一个气体体积减小的反应,恒压条件下,相当给原平衡加压,平衡正向移动,转化率变大,放出热量增多,d>b;(7)根据图像可知,t1时刻,正逆反应速率都增大,且逆反应速率增幅大,所以一定是升高温度,t4时刻,正逆反应速率都减小,且正反应速率减幅大,所以一定是降低压强。 本题难度:困难 5、选择题 对于可逆反应:2A(g)+B(g) 参考答案:A 本题解析:该反应为放热反应,温度越高反应速率越快,达到平衡需要时间越短,升高温度,平衡向逆反应方向移动,C体积分数减小,A正确;增大压强,正、逆反应速率都加快,平衡向正反应方向移动,v(正)>v(逆),B错误;加催化剂对平衡移动无影响,只是增大反应速率,缩短达到平衡需要的时间,C错误;温度相同时,增大压强,平衡向正反应方向移动,A的转化率增大。压强相同时,温度越高,A的转化率越小,D错误。 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《物质的量》.. | |