1、计算题 将一生锈的铁片置于稀硝酸中,反应结束后,共收集11.2L NO气体(标况)。溶液中还剩下固体残渣5g,过滤后向浅绿色溶液中通入35.5g氯气,恰好使Fe2+全部氧化,求原铁片的质量和铁锈的百分含量(铁锈成分以Fe2O3计算)。(保留两位小数)
参考答案:65g,? 20.51%
本题解析:略
本题难度:一般
2、选择题 将一浅绿色溶液,置于空气中,变黄色。将此黄色溶液逐滴滴入沸水中,
形成一种红褐色胶体,下列说法中错误的是( )
A.该浅绿色溶液中含有Fe2+,在空气中被氧化为Fe3+
B.欲检验该黄色溶液中是否含有未被氧化的Fe2+,向其中滴加KSCN溶液
C.配制该浅绿色溶液,要向其中加少量酸与铁粉,目的是为了防止Fe2+的水解与氧化
D.欲检验浅绿色溶液中是否含有Fe3+,滴入KSCN溶液,看是否变红色
参考答案:B
本题解析:向该黄色溶液中滴加KSCN溶液,溶液变红色,可以证明含有Fe3+,无法证明是否含有未被氧化的Fe2+。
本题难度:一般
3、填空题 以硫铁矿烧渣(含有氧化铁和少量硫化亚铁、二氧化硅等)为原料制备聚铁{可表示为Fe2(OH)n(SO4)3-n/2,和绿矾(FeSO4.7H2O)具有成本低、反应快、产品质量高等优点。制备流程如下图:
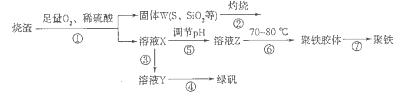
(1)流程图中溶液X为Fe(SO4)3,溶液,据此写出操作①中属于氧化还原反应的离子方程式:____________。
(2)操作②的处理存在弊端,该弊端是_____________。若固体W与KOH溶液昆合加热,其中一个反应的化学方程式为3S+6KOH 2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___________。
2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___________。
(3)操作③需要加入的物质(试剂)是_________,目的是___________________________。
(4)操作⑤是使溶液pH___________(填“增大”或“减小”)。
(5)操作⑥控制温度为70 -80℃的目的是_________________________________________ 。
(6)双氧水在酸性环境(硫酸)中是一种强氧化剂,可以将硫酸亚铁氧化成三价铁,制得Fe2(OH)n(SO4)3-n/2,反应的化学方程式为__________________________________。
参考答案:(1)4FeS+3O2+12H+=4Fe3++6H2O+4S
(2)燃烧产物SO2会造成环境污染? 2:1
(3)铁粉?使Fe3+还原为Fe2+
(4)增大
(5)促进Fe3+水解。又不至于Fe3+完全水解生成氢氧化铁胶体
(6)2FeSO4+H2O2+(1-n/2)H2SO4=Fe2(OH)n(SO4)3-n/2+(2-n)H2O
本题解析:(1)氧化还原反应的特征是元素的化合价的升降。发生的反应中属于氧化还原反应的为:4FeS+3O2+12H+=4Fe3++6H2O+4S。
(2)在固体W中含有S、SiO2,在灼烧时S被氧化为SO2而逸出,导致环境污染。在反应3S+6KOH 2K2S+K2SO3+3H2O中,S既作氧化剂,也作还原剂,其中2个S作氧化剂,1个S作还原剂。所以该反应的氧化剂与还原剂质量之比为2:1。
2K2S+K2SO3+3H2O中,S既作氧化剂,也作还原剂,其中2个S作氧化剂,1个S作还原剂。所以该反应的氧化剂与还原剂质量之比为2:1。
(3)溶液X为Fe(SO4)3,向其中加入Fe粉使硫酸铁还原为硫酸亚铁,然后蒸发、结晶得到绿矾。
(4)操作⑤是使溶液pH增大以抑制Fe3+的水解。
(5)操作⑥控制温度为70 -80℃的目的是促进Fe3+水解,而又不至于Fe3+完全水解生成氢氧化铁胶体。
(6)双氧水在酸性环境(硫酸)中是一种强氧化剂,可以将硫酸亚铁氧化成三价铁,制得Fe2(OH)n(SO4)3-n/2。根据电子守恒和质量守恒定律可得反应的化学方程式为2FeSO4+H2O2+(1-n/2)H2SO4=Fe2(OH)n(SO4)3-n/2+(2-n)H2O。
本题难度:一般
4、选择题 已知氯化铁溶液中通入硫化氢可发生反应:2FeCl3+H2S→2FeCl2+S↓+2HCl。在标准状况下,向? 100mLFeCl3溶液中通入aL的H2S气体恰好反应后,再加入足量的铁粉充分反应。所得溶液经测定金属阳离子的浓度为3mol/L,若反应过程中溶液体积不变,则原FeCl3溶液的物质的量浓度为?(?)
A.1.5mol/L
B.2moi/L
C.lmol/L
D.无法确定
参考答案:B
本题解析:
2FeCl3+H2S=2FeCl2+S↓+2HCl
2HCl+Fe=FeCl2+H2↑
得关系式
2FeCl3~3FeCl2
2? 3
2mol/L? 3mol/L
正确答案选B
本题难度:一般
5、选择题 部分氧化的Fe—Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:

下列说法正确的是
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.V=224
C.样品中CuO的质量为4.0g
D.V=448
参考答案:D
本题解析:推断一:滤渣3.2g一定是全部的铜(硫酸足量可以说明沉淀中无Fe、CuO、Fe2O3,溶液无铜离子可以说明铜都析出了);固体为铜说明溶液中中没有Fe3+(它要和铜反应),所以A错。推断二:最后灼烧得到固体3.2g为Fe2O3,其中含铁元素质量为3.2×112/160=2.24g。铁元素质量=2.24g,而原来固体才5.76g,所以CuO质量不超过5.76-2.24=3.52g,所以C错。推断三:由于最后溶液中溶质为过量H2SO4和FeSO4,而铁元素物质的量=2.24/56=0.04mol,说明参加反应硫酸物质的量=0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,由于合金中氧物质的量=(5.76-3.2-2.24)/16=0.02mol,它结合氢离子0.04mol,所以硫酸中有0.08-0.04=0.04molH+生成氢气,即生成0.02mol氢气,标况体积为448ml,D对。
点评:本题需要讨论三种不同的情况来对选项进行分析。需要学生逻辑清晰,有一定难度。
本题难度:一般