1、选择题 在一个容积为V?L的密闭容器中,放入2?L?A(g)和1?L?B(g),在一定条件下发生下列反应:3A(g)+B(g)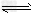 nC(g)+2D(g).达到平衡后,A物质的量浓度减小1/2,混合气的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是
nC(g)+2D(g).达到平衡后,A物质的量浓度减小1/2,混合气的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是
[? ]
A.1
B.2
C.3? ?
D.4
参考答案:A
本题解析:
本题难度:一般
2、选择题 t℃时,在一密闭容器中充入2molA和3molB,发生如下化学反应:aA(g)+B(g) C(g)+D(g) 已知,平衡时,Ca(A)·C(B)= C(C)·C(D),然后在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,则B的转化率是?(?)
C(g)+D(g) 已知,平衡时,Ca(A)·C(B)= C(C)·C(D),然后在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,则B的转化率是?(?)
A. 60%? B. 40%? C. 4%? D. 无法确定
参考答案:B
本题解析:平衡时,Ca(A)·C(B)= C(C)·C(D),则平衡常数K=1。在温度不变的情况下,扩大容器容积至原来10倍,A的百分含量始终未有改变,这说明反应前后体积是不变的,因此α=1。设B的转化率是x,则生成C、D的物质的量都是3x。平衡时剩余A和B分别是2-3x、3-3x,所以 ,解得x=0.4,答案选B。
,解得x=0.4,答案选B。
本题难度:一般
3、选择题 1000℃时,FeO(s) + H2 ?Fe(s) + H2O,K=0.52。欲使容器中有1.0 mol FeO被还原,反应前容器中应充入a mol H2。则a最接近
?Fe(s) + H2O,K=0.52。欲使容器中有1.0 mol FeO被还原,反应前容器中应充入a mol H2。则a最接近
A.1.0
B.2.0
C.3.0
D.4.0
参考答案:C
本题解析:根据方程式可知,消耗氢气的物质的量是1mol,生成水蒸气是1mol,剩余氢气是(a-1)mol。由于反应前后体积不变,则可以用物质的量代替浓度表示平衡常数,则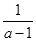 ?=0.52,解得a=2.93,属于答案选C。
?=0.52,解得a=2.93,属于答案选C。
本题难度:一般
4、选择题 温度为T时,向2 L恒容密闭容器中充入1 mol PCl5,发生PCl5(g)  ?PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是(?)
?PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是(?)
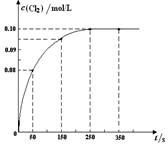
A.反应在0 ~50 s 的平均速率v(Cl2) =1.6×10-3mol/(L·s)
B.该温度下,反应的平衡常数K = 0.025(不考虑单位)
C.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,则该反应的ΔH <0
D.反应达平衡后,再向容器中充入 1 mol PCl5,该温度下再达到平衡时,0.1 mol/L<c(Cl2)<0.2 mol/L
参考答案:C
本题解析:A、由图可知,0~50s 内Cl2的浓度变化量为0.08mol/L,根据v=△c/△t计算v(Cl2)=1.6×10-3mol/(L?s),正确;B、由图可知,250s时达到平衡,平衡时c(Cl2)=0.1mol/L,利用三段式计算平衡时各组分的浓度,代入平衡常数表达式计算,
PCl5(g) PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
开始(mol/L):0.5? 0? 0
变化(mol/L):0.1? 0.1? 0.1
平衡(mol/L):0.4? 0.1? 0.1
故该温度下平衡常数k=0.025,正确;C、由B可知,平衡时c(PCl3)=0.1mol/L,保持其他条件不变,升高温度,平衡时c′(PCl3)=0.11mol/L,浓度增大,平衡向正反应移动,该反应为吸热反应,△H>0,错误; D、反应达平衡后,再向容器中充入 1mol PCl5,平衡向正反应移动,等效为增大压强,增大压强,与原平衡相比PCl5转化率降低,故达平衡时0.1mol/L<c(Cl2)<0.2mol/L,正确。
本题难度:一般
5、填空题 在2L密闭容器内,800℃时反应2NO(g)+O2(g)  ?2NO2(g)体系中,n(NO)随时间的变化如下表:
?2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s
| 0
| 1
| 2
| 3
| 4
| 5
|
n(NO)/mol
| 0.020
| 0.010
| 0.008
| 0.007
| 0.007
| 0.007
|
(1)写出该反应的平衡常数表达式:K=__________。已知:K300 ℃>K350 ℃,则该反应是__________热反应。
(2)右图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=__________。
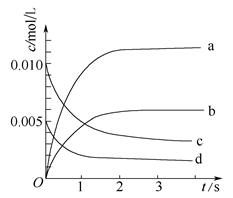
(3)能说明该反应已达到平衡状态的是__________。
a.v(NO2)=2v(O2)?
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)?
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离出NO2气体 ?
b.适当升高温度
c.增大O2的浓度?
d.选择高效催化剂
参考答案:(每空2分,共12分)(1)K=? 放?
(2)b 1.5×10-3 mol/(L·s)? (3)bc ? (4)c
本题解析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知,该反应的平衡常数表达式是
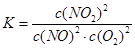 。温度越高,平衡常数越小,所以正方应是放热反应。
。温度越高,平衡常数越小,所以正方应是放热反应。
(2)根据表中数据可知,平衡是消耗NO是0.02mol-0.007mol=0.013mol,所以根据方程式可知,生成NO2是0.013mol,浓度是0.0065mol/L,则b曲线符合。从0~2 s内NO减少了0.02mol-0.008mol=0.012mol,则氧气减少了0.006mol,所以用氧气表示的反应速率是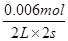 =1.5×10-3 mol/(L·s)。
=1.5×10-3 mol/(L·s)。
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。速率之比是相应的化学计量数之比,所以a中的关系始终是成立的,不能说明;该反应是体积减小的可逆反应,则压强也是减小的,因此当压强不在发生变化时可用说明;c中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,d不能说明,因此答案选bc。
(4)及时分离出NO2气体,反应速率降低;适当升高温度,反应速率加快,但平衡向逆反应方向移动;增大O2的浓度,反应速率加快,平衡向正反应方向移动;催化剂不能改变平衡状态,答案选c。
点评:该题是高考中的常见题型,属于中等难度试题的考查。试题在注重对学生基础知识巩固的训练的同时,更侧重对学生能力的培养和解题方法的指导与训练,有利于调动学生的学习兴趣和学习积极性,激发学生的学习求知欲。也有助于培养学生的逻辑推理能力和抽象思维能力。
本题难度:一般