1、填空题 海洋是个巨大的资源宝库,海水资源的利用具有非常广阔的发展前景。海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下所示:
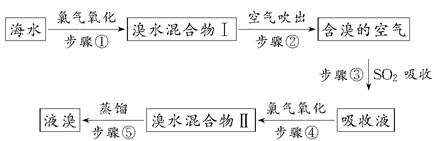
(1)步骤①反应的廊子方程式为_______________________________。
(2)步骤③反应的化学方程式为_________________________________。
(3)Br的原子序数是________,在周期表中位于第________周期、________族。
(4)步骤⑤蒸馏的过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:________________。
(5)为什么不直接用“溴水混合物Ⅰ”而要用“溴水混合物Ⅱ”进行蒸馏,得出液溴?
参考答案:(1)2Br-+Cl2=Br2+2Cl- (2)SO2+Br2+2H2O=2HBr+H2SO4 (3)35 四 ⅦA (4)温度过高,大量水蒸气随溴蒸气排出,溴蒸气中水增加,温度过低,溴不能完全蒸出,回收率降低 (5)“溴水混合物Ⅰ”中虽然含有溴单质,但浓度低,如果直接蒸馏,处理量大,生产成本高;经过“空气吹出、SO2吸收、氯气氧化”等步骤实际上是将溴水浓缩了
本题解析:(1)Cl的非金属性大于Br,海水中含有的Br-被氯气置换,Cl2+2Br-=Br2+2Cl-。
(2)空气中的Br2与SO2反应,得到含高浓度Br-的溶液,SO2+2H2O+Br2=2HBr+H2SO4。
(3)溴为第四周期,ⅦA族元素;根据各周期元素的个数,计算第四周期稀有气体元素的原子序数,由此推出Br的原子序数=2+8+8+18-1=35。
(4)根据蒸馏分离原理进行回答。水的沸点为100℃,温度过高水蒸发量增大,温度过低,溴的挥发量减少,不能完全蒸出,回收率降低。
(5)海水中Br-的含量很低,因此“溴水混合物Ⅰ”中溴的含量很低,直接蒸馏,处理液体的量很大,能耗高,成本增加;经过一系列处理后的“溴水混合物Ⅱ”中Br2的浓度增大,蒸馏时,所需处理的液体量大大减少,能耗降低,成本降低。
本题难度:一般
2、选择题 下列关于能源和作为能源物质的叙述中不正确的是
A.人类利用的能源都是通过化学反应获得的
B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C.物质的化学能可以在不同条件下转为热能、电能为人类所利用
D.化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能
参考答案:A
本题解析:A不正确,人类利用的能源的途径十分广泛,主要有:化学反应获得、风能、水能、潮汐能、太阳能等,并非都是通过化学反应获得。
本题难度:一般
3、选择题 以海水为原料制取金属镁的生产步骤的顺序正确的是
①过滤?②加盐酸?③浓缩结晶?④加入熟石灰?⑤电解熔融的MgCl2
A.①②③④⑤
B.④①②③⑤
C.③②④①⑤
D.②①③⑤④
参考答案:B
本题解析:略
本题难度:一般
4、填空题 氢氧化钠是一种用途十分广泛的化工原料。工业上主要通过电解氯化钠饱和溶液的方法获得氢氧化钠,我国的氯碱工业大多数采用离子交换膜电解槽。
(1)离子交换膜电解槽一般采用金属钛作阳极,其原因是__________________________________。
阴极一般用碳钢网制成。阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是____________________________________。
(2)为使电解氯化钠的速率加快,下列措施可行的是__________。
a.增大阴极碳钢网的面积
b.提高饱和氯化钠溶液的温度
c.加大阴极与阳极间的距离
d.提高电解时电源电压
(3)如果将某离子交换膜电解槽的①电解时电压增大到原来的2倍;②电解时的电流强度增大到原来的2倍;③电解时温度从30 ℃提高到60 ℃,则电解速率一定会达到原来的2倍的是________________。
参考答案:(1)阳极产生的Cl2不易腐蚀钛 既能防止H2、Cl2混合爆炸,又能避免Cl2与NaOH反应
(2)abd (3)②
本题解析:电解时H+、Cl-分别在阴阳两极上得失电子,产生H2和Cl2,阳极材料必须选择不易被Cl2腐蚀的材料;增大面积、提高温度、增大电压都有利于加快电解食盐水的速率。当电解时电压增大到原来的2倍,电解池的电阻可能发生变化,电解时的电流强度不一定增大到原来的2倍;电解时温度从30 ℃提高到60 ℃,电解池的内阻会有所降低,但并不一定恰好降低为原来的一半;当电解时的电流强度增大到原来的2倍,单位时间内流过电路的电量恰好为原来的2倍,发生反应的物质的量也恰好为原来的2倍,即反应速率为原来的2倍。
本题难度:一般
5、选择题 19世纪末,被认为是稀罕的贵金属铝,价格大大下降,这是因为发现了 (? )
A.大量铝土矿
B.电解氧化铝制取铝的方法
C.用金属钠还原氧化铝的方法
D.无水氯化铝与钾制取铝的方法
参考答案:B
本题解析:金属铝比较活泼,不易还原,从矿石中很难到。金属铝的冶炼方法先进主要为点解氧化铝的方法。
本题难度:简单