1、选择题 甲、乙两元素原子的L层电子数都是其他层电子总数的2倍.下列推断正确的是( )
A.甲与乙处于同一周期
B.甲与乙处于同一主族
C.甲与乙的单质都是原子晶体
D.甲与乙的原子序数之和为偶数
参考答案:L层最多可有8个电子,当其他层共有4个电子时符合题意,根据核外电子排布规律,该条件下,原子有3个电子层,最外层有2个电子,Mg符合条件;当L层未填满电子时,K层的2个电子已填入,此时L层应有4个电子,碳符合条件,则甲、乙指的是碳和镁.
A、由上述分析可知,甲、乙是碳和镁,碳处于第二周期,镁处于第三周期,二者不处于同一周期,故A错误;
B、由上述分析可知,甲、乙是碳和镁,碳处于第ⅣA族,镁处于第ⅡA族,故B错误;
C、甲、乙是碳和镁,碳单质金刚石为原子晶体,镁属于金属晶体,故C错误;
D、甲、乙指的是碳和镁,原子序数之和为18,故D正确.
故选:D.
本题解析:
本题难度:简单
2、选择题 短周期元素X、Y、Z、W原子序数依次增大,它们原子的最外层电子数之和为14.X与Z同主族.Y与W同主族,且X的原子半径小于Y.下列叙述正确的是( )
A.原子半径:Y<Z<W
B.Z在化合物中呈+1价
C.Y与W可形成离子化合物
D.Z的单质不能与X的氧化物反应
参考答案:短周期元素X、Y、Z、W的原子序数依次增大,X与Z同主族,Y与W同主族,则Y与W分别位于第二、第三周期,X的原子半径小于Y,X不可能处于第二周期,故X为H元素,Z为Na元素,X、Y、Z、W的原子最外层电子数之和为14,故Y、W的最外层电子数为14-1-12=6,故Y为O元素,W为S元素,
A、同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Na>S>O,即Z>W>Y,故A错误;
B、Z为Na元素,原子最外层电子数为1,在化合物中呈+1价,故B正确;
C、Y为O元素,W为S元素,二者形成的化合物SO2、SO3,都属于共价化合物,故C错误;
D、钠与水反应生成氢氧化钠与氢气,故D错误;
故选B.
本题解析:
本题难度:一般
3、填空题 X、Y、Z、M、N、K是由短周期元素构成的微粒,其中X、Y、Z是阳离子,M、N是中性分子,K是阴离子,它们具有下列结构特点和性质:
①它们核外电子总数都相同;?
②N溶于M中,滴入酚酞,溶液变红;
③X和N都由A、C两元素组成,X和Y核内质子数相等;
④Y和K都由A、B两元素组成,Y核内质子总数比K多两个;
⑤Z为单核离子,且离子半径是与其具有相同电子层结构离子中半径最小的.
根据以上信息,请回答下列问题:
(1)Y的化学式为______,X的电子式为______.
(2)试比较M和N的稳定性:M______N(填“>”、“<”、“=”)
(3)检验X的方法是______.
(4)由A、B、C三种元素组成的物质中,属于离子化合物的有______,属于共价化合物的有______(各任写一种物质的化学式)
(5)上述六种微粒中的两种可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入0.1mol/L氢氧化钠溶液,随着氢氧化钠溶液的加入,产生沉淀的关系如图,则该复盐的化学式为______.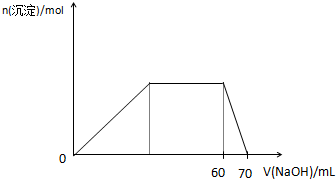
参考答案:根据 ②N溶于M中可初步判定M为H2O(最常见的溶剂);
再由①知都是10电子,N的水溶液显碱性,所以N为NH3(中学化学中唯一的碱性气体);
由③中A、B两种元素形成的阴阳离子质子数差2,则Y为H3O+,K为OH-,A、B为H、O两元素;
由④知:X为NH4+,则C为N元素;
Z为单核离子,且离子半径是与其具有相同电子层结构离子中半径最小的,则Z为铝离子,则
(1)Y为H3O+,X为NH4+,电子式为
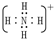
,故答案为:H3O+,
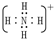
;
(2)M为H2O,N为NH3,由于非金属性:O>N,元素的非金属性越强,对应的氢化物越稳定,则稳定性:H2O>NH3,故答案为:>;
(3)检验,可根据NH4+与OH-反应生成碱性气体NH3,能使湿润的红色石蕊试纸变蓝进行检验,
故答案为:用试管取含X的溶液少量,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体;
(4)A、B为H、O元素,C为N元素,形成的离子化合物有NH4NO3、NH4NO2等,共价化合物有HNO3、HNO2等,
故答案为:NH4NO3等;HNO3等;
(5)能生成白色沉淀,说明含有Al3+,开始发生:Al3++3OH-=Al(OH)3↓,然后沉淀的质量不变,则应发生:NH4++OH-=NH3?H2O,最后发生:Al(OH)3+OH-=AlO2-+2H2O,根据图象横坐标可知:n(NH4+):n(Al3+)=3:1,则该复盐的化学式为(NH4)3?Al(SO4)3或3(NH4)2?SO4﹒Al2(SO4)3,
故答案为:(NH4)3?Al(SO4)3或3(NH4)2?SO4﹒Al2(SO4)3.
本题解析:
本题难度:一般
4、填空题 有原子序数依次增大的五种短周期元素A、B、C、D、E,已知?A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y;A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物,回答下列问题:
(1)B在周期表中的位置是______,E的原子结构示意图______
(2)写出同时含A、B、C、D四种元素的两种盐的化学式______、______
(3)BD2的结构式为______,E和D形成的一种化合物与BD2发生氧化还原反应,该反应的方程式为______
(4)C元素的最高价氧化物的水化物与其氢化物反应的离子方程式______
(5)在一定条件下,一定量的A的单质与C的单质反应,可生成17克气体化合物CA3,同时放出46kJ的热量,写出该反应的热化学方程式______.
参考答案:有原子序数依次增大的五种短周期元素A、B、C、D、E,A元素的原子半径最小,则A为H;B元素原子的最外层电子数是内层电子数的2倍,则内层电子数为2,最外层电子数为4,即B为C;C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,Y为硝酸铵,即C为N;A、E同主族,则E为Na;A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物,则D为O,
(1)B为C,位于元素周期表中的第二周期第ⅣA族,E为Na,原子结构示意图为

,
故答案为:第二周期第ⅣA族;

;
(2)盐是由阳离子与酸根离子构成,A、B、C、D四种元素的两种盐的阳离子只能为铵根离子,则盐为NH4HCO3、CH3COONH4,故答案为:NH4HCO3;CH3COONH4;
(3)BD2为CO2,其结构式为O=C=O,与过氧化钠反应生成碳酸钠和氧气,反应为2Na2O2 +2CO2 =2Na2CO3 +O2,
故答案为:O=C=O;2Na2O2 +2CO2 =2Na2CO3 +O2;
(4)C元素的最高价氧化物的水化物为硝酸,氢化物为氨气,则二者反应的离子反应为NH3 +H+=NH4+,
故答案为:NH3 +H+=NH4+;
(5)氮气与氢气生成17g氨气放出46kJ的热量,则生成2molNH3放出92kJ的热量,则热化学反应方程式为
N2(g)+3H2(g)=2NH3(g)△H=-92 kJ?mol-1,
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92 kJ?mol-1.
本题解析:
本题难度:一般
5、选择题 1999年曾报导合成和分离了含能量的正离子N5+的化合物N5AsF6,下列错误的是
[? ]
A.N5+共有34个核外电子
B.N5+中氮原子之间以共用电子对结合
C.化合物N5AsF6中As化合价为+1
D.化合物N5AsF6中F化合价为-1
参考答案:C
本题解析:
本题难度:简单