1、选择题 对反应A+B AB来说,常温下按以下情况进行反应:
AB来说,常温下按以下情况进行反应:
①20 mL溶液中含A、B各0.01 mol ②50 mL溶液中含A、B各0.05 mol
③0.1 mol·L-1的A、B溶液各10 mL ④0.5 mol·L-1的A、B溶液各50 mL
四者反应速率的大小关系是 ( )
A.②>①>④>③ B.④>③>②>① C.①>②>④>③ D.①>②>③>④
参考答案:A
本题解析:在其它条件不变的情况下,反应物的浓度越大,反应速率越快。①、②、③、④中反应物的浓度分别是0.01mol÷0.02L=0.5mol/L、0.05mol÷0.05L=1mol/L、0.1mol/L÷2=0.05mol/L、0.5mol/L÷2=0.25mol/L,所以反应速率大小关系是②>①>④>③,答案选A。
考点:考查反应速率大小比较
本题难度:一般
2、选择题 对于反应M+N=P,如果温度每升高10 ℃,反应速率增大为原来的3倍。在10 ℃时完成反应的10%需要54 min,将温度提高到40 ℃完成反应的10%,需要的时间为(? )。
A.2 min
B.3 min
C.6 min
D.9 min
参考答案:A
本题解析:本题要弄清两个问题:①时间与速率关系,②速率与温度关系。因每升高10 ℃反应速率增大为原来的3倍,如升高的温度为Δt,则反应速率增加为原来的 倍,反应温度由10 ℃升至40 ℃,反应速率增加为原来的33倍,完成反应的10%需要时间为
倍,反应温度由10 ℃升至40 ℃,反应速率增加为原来的33倍,完成反应的10%需要时间为 ="2" min。
="2" min。
本题难度:一般
3、选择题 实验室测得4molSO2参加下列反应:2SO2(g)+O2(g)  2SO3(g);
2SO3(g);
△H=-196.64kJ/mol,当放出314.3kJ热量时,SO2的转化率最接近于?
A.40%
B.50%
C.80%
D.90%
参考答案:C
本题解析:根据热化学方程式可知,参加反应的SO2是314.3kJ÷196.64kJ/mol×2=3.mol,所以转化率是3.2mol÷4mol×100%=80%,答案选C。
本题难度:一般
4、选择题 汽车尾气的无害化处理的反应为2CO(g)+2NO(g) N2(g)+2CO2(g) △H<0下列说法不正确的是
N2(g)+2CO2(g) △H<0下列说法不正确的是
A.升高温度,正逆反应速率都加快
B.使用催化剂,正逆反应速率都加快
C.使用催化剂,可以降低活化能
D.升高温度,上述反应的平衡常数会增大
参考答案:D
本题解析:反应2CO(g)+2NO(g) N2(g)+2CO2(g) △H<0正反应方向为放热反应,所以
N2(g)+2CO2(g) △H<0正反应方向为放热反应,所以
A正确,升高温度反应速率加快;B正确,催化剂能加快反应速率;C正确,催化剂能降低反应反应需的活化能,加快反应速率;D错,升高温度,该反应向逆反应方向移动,平衡常数减小;
本题难度:一般
5、选择题 500℃、20Mpa时,将H2和N2置于一容积为2L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是
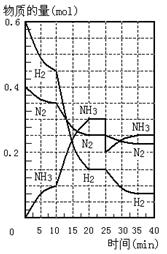
A.反应开始到第一次平衡时,N2的平均反应速率为0.005mol/(L·min)
B.从曲线变化可以看出,反应进行到10min至20min钟时可能是使用了催化剂
C.从曲线变化可以看出,反应进行至25min钟时,分离出0.2mol的氨气
D.在25min钟时平衡正向移动但达到新平衡后 NH3的体积分数比原平衡小
参考答案:B
本题解析:略
本题难度:简单