1、选择题 对于Zn(s)+H2SO4(l)==ZnSO4(l)+H2(g);ΔH <0 的化学反应下列叙述不正确的是(? )
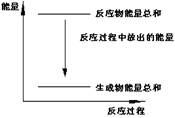
A.反应过程中能量关系可用上图表示
B.ΔH的值与反应方程式的计量系数有关
C.若将该反应设计成原电池锌为负极
D.若将其设计为原电池当有32.5g锌溶解时,正极F放出气体一定为11.2L
参考答案:D
本题解析:根据图像可知,反应物的总能量高于生成物的总能量,所以是放热反应。而锌与稀硫酸的反应是就是放热反应,所以选项A正确。反应热和化学计量数有关系,B正确。该反应是氧化还原反应,所以能设计成原电池,C正确。32.5g锌失去32.5g÷65g/mol×2=1.0mol,所以生成氢气是0.5mol,但体积不一定是11.2L,选项D不正确,答案选D。
本题难度:一般
2、选择题 已知断开或形成1 mol化学键吸收或放出的能量称为化学键的键能,如H—H键的键能为436 kJ·mol-1,N≡N键的键能为945 kJ·mol-1,N—H键的键能为391 kJ·mol-1。则下列有关工业合成氨反应的热化学方程式正确的是? ( )
A.N2(g)+3H2(g)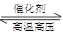 2NH3(g) ΔH=-93 kJ·mol-1
2NH3(g) ΔH=-93 kJ·mol-1
B.N2(g)+3H2(g)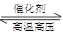 2NH3(g) ΔH=+1471 kJ·mol-1
2NH3(g) ΔH=+1471 kJ·mol-1
C.N2(g)+3H2(g)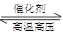 2NH3(g) ΔH=+93 kJ·mol-1
2NH3(g) ΔH=+93 kJ·mol-1
D.N2(g)+3H2(g) 2NH3(g) ΔH=-1471 kJ·mol-1
2NH3(g) ΔH=-1471 kJ·mol-1
参考答案:A
本题解析:根据反应热和键能的关系可得,ΔH=945 kJ·mol-1+3×436 kJ·mol-1-6×391 kJ·mol-1=-93 kJ·mol-1。
本题难度:一般
3、选择题 有关热化学方程式书写与对应表述均正确的是
A.稀醋酸与0.1 mol·L-1 NaOH溶液反应:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
B.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量,则Fe(s)+S(s)==="FeS(s)" ΔH=-95.6 kJ·mol-1
C.氢气的燃烧热为285.5 kJ·mol-1,则水电解的热化学方程式为2H2O(l)===2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
D.已知2C(s)+O2(g)==="2CO(g)" ΔH=-221 kJ·mol-1,则可知C的燃烧热为110.5 kJ·mol-1
参考答案:B
本题解析:A项醋酸是弱电解质,不用H+表示;17.6 g硫化亚铁为0.2 mol,放出热量为19.12 kJ,故生成1 mol FeS时放出的热量为95.6 kJ,故B选项正确;燃烧热是指1 mol可燃物完全燃烧生成稳定氧化物时放出的热量,即1 mol氢气完全燃烧生成液态水时放出的热量为285.5 kJ,则电解1 mol H2O时要吸收285.5 kJ热量,故热化学方程式为2H2O(l)===2H2(g)+O2(g) ΔH=+285.5×2 kJ·mol,故C选项错误;D项碳的燃烧热是1 mol C完全燃烧生成CO2时放出的热量,故D选项错误。
本题难度:一般
4、选择题 在一定条件下A与B反应可生成C和D,其能量变化如图:

下列有关反应A+B=C+D的说法正确的是?( )。
A.反应前后原子的种类和数目一定不变
B.反应前后分子的种类和数目一定改变
C.反应物的总能量E1与生成物的总能量E2一定相等
D.此反应一定有热量的变化
参考答案:A
本题解析:B项,分子的种类一定发生了变化,但是分子数目不一定发生变化;C项,化学反应在发生物质变化的同时,一定伴随着能量的变化;D项,有能量的变化,不一定有热量的变化。
本题难度:简单
5、简答题 (14分)化学在能源开发与利用中起着十分重要的作用。
(1)蕴藏在海底的可燃冰是高压下形成的外观像冰的甲烷水合物固体.被称之为“未来能源”。在25℃、101 kPa下,1g甲烷完全燃烧生成和液态水时放热55.6 kJ。甲烷燃烧的热化学方程式为 ______:相同条件下,356 g可燃冰(分子式为CH4·9H2O,Mr=178)释放的甲烷气体完全燃烧生成CO2和液态水,放出的热量为_______kJ。
(2)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,具有清洁、高效的优良性能。由合成气(组成为H2、CO和少量的CO2)直接制各二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(Ⅰ)CO(g)+2H2(g)═CH3OH(g)?△H1=-90.1kJ?mol-1
(Ⅱ)CO2(g)+3H2(g)═CH3OH(g)+H2O(g)?△H2=-49.0kJ?mol-1
水煤气变换反应:(Ⅲ)CO(g)+H2O(g)═CO2(g)+H2?(g) △H3=-41.1kJ?mol-1
二甲醚合成反应:(Ⅳ)2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24.5kJ?mol-1
①分析二甲醚合成反应(iv)对于CO转化率的影响___________________________________。
②由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为:__________________。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响_________________________________。
(3)二甲醚直接燃料电池具有启动快、效率高等优点。若电解质为碱性,二甲醚直接燃料电池的负极反应为______________________,一个二甲醚分子经过电化学氧化,可以产生________电子的电量。
参考答案:(1)2O2(g)+CH4(g)═CO2(g)+H2O(l)?△H=-889.6kJ/mol? 1779.2
(2)①消耗甲醇,促进甲醇合成反应(Ⅰ)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(Ⅲ)消耗部分CO
②2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)?△H=-204.7kJ?mol-1
该反应分子数减少,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加.压强升高使CO和H2浓度增加,反应速率增大
(3)CH3OCH3+16OH--12e-=2CO32-+11H2O;12
本题解析:(1)1g甲烷完全燃烧生成和液态水时放热55.6 kJ,则16g甲烷即1mol甲烷完全燃烧生成和液态水时放热55.6 kJ×16=889.6kJ,因此甲烷燃烧的热化学方程式为2O2(g)+CH4(g)═CO2(g)+H2O(l)?△H=-889.6kJ/mol。356 g可燃冰(分子式为CH4·9H2O,Mr=178)中甲烷的质量是356g×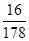 =32g,即含有2mol甲烷,所以释放的甲烷气体完全燃烧生成CO2和液态水,放出的热量为889.6kJ/mol×2mol=1779.2kJ。
=32g,即含有2mol甲烷,所以释放的甲烷气体完全燃烧生成CO2和液态水,放出的热量为889.6kJ/mol×2mol=1779.2kJ。
(2)①二甲醚合成反应(Ⅳ)对于CO转化率的影响,消耗甲醇,促进甲醇合成反应(Ⅰ)CO(g)+2H2(g)═CH3OH(g)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(Ⅲ)CO(g)+H2O(g)═CO2(g)+H2?(g)消耗部分CO,故答案为:消耗甲醇,促进甲醇合成反应(Ⅰ)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(Ⅲ)消耗部分CO;
②Ⅰ、CO(g)+2H2(g)═CH3OH(g)△H1=-90.1kJ?mol-1、Ⅳ、2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24.5kJ?mol-1,依据盖斯定律Ⅰ×2+Ⅳ得到:2CO(g)+4H2(g)=CH3OCH3+H2O(g) △H=-204.7kJ?mol-1。该反应是气体体积减小的反应,增加压强平衡正向进行,反应速率增大,CO和H2转化率增大,CH3OCH3产率增加;故答案为:2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)△H=-204.7kJ?mol-1;该反应分子数减少,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加.压强升高使CO和H2浓度增加,反应速率增大;
(3)原电池中负极失去电子,则二甲醚在负极发生氧化反应。若电解质为碱性,二甲醚直接燃料电池的负极反应为二甲醚失电子生成碳酸根,结合原子守恒和电荷守恒写出电极反应为:CH3OCH3+16OH--12e-=2CO32-+11H2O;?根据负极电极反应式可知一个二甲醚分子经过电化学氧化,可以产生12个电子的电量。
本题难度:一般