1、选择题 下列对于“摩尔”的理解正确的是
A.摩尔是国际科学界建议采用的一种物理量
B.摩尔是物质的量的单位,简称摩,符号为mol
C.1mol H2的质量为2g?mol-1
D.1mol 氧含6.02×1023个O2
参考答案:B
本题解析:分析:据物质的量定义及单位判断A、B,据质量的单位判断C,据氧的明确概念判断D.
解答:A、物质的量是国际科学界建议采用的一种物理量,单位是mol,故A错.
B、摩尔是物质的量的单位,简称摩,符号为mol,故B正确.
C、质量的单位是g,1mol氢气的质量是2g,故C错.
D、氧是分子还是原子,叙述不明确,故D错.
故选:B
点评:摩尔是单位不是物理量,质量与摩尔质量的单位易混淆,微粒的指定要有明确性,这些都是化学用语使用不规范.
本题难度:简单
2、选择题 下列是我们日常生活中接触到的物质,其中属于纯净物的是
A.碘酒
B.蒸馏水
C.可乐饮料
D.铝合金
参考答案:B
本题解析:分析:纯净物是由一种物质组成的物质.混合物是由多种物质组成的物质.可以根据物质的组成方面进行分析、判断,从而得出正确的结论.
解答:A、碘酒是由碘和酒精组成的物质,属于混合物,故A错误;
B、蒸馏水中只有一种物质水,属于纯净物,故B正确;
C、可乐饮料中含有碳酸、水等物质,属于混合物,故C错误;
D、铝合金的主要成分是铝,还含有一些其它物质,属于混合物,故D错误;
故选B.
点评:本题考查纯净物和混合物的定义,解答本题的关键是要正确分析物质是由哪些物质组成的,只有这样才能对物质进行正确的分类.
本题难度:简单
3、选择题 在标况下,下列气体含有的分子数最多的是
A.17g NH3
B.67.2L Cl2
C.4g H2
D.0.5mol SO2
参考答案:B
本题解析:分析:计算各物质的物质的量,根据N=nNA可知,物质的量越大,分子数目越多.通过比较物质的量判断.
解答:A、17g氨气的物质的量为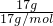 =1mol,
=1mol,
B、标准状况下,67.2L的氯气的物质的量为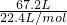 =3mol,
=3mol,
C、4g氢气的物质的量为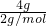 =2mol,
=2mol,
D、0.5mol SO2.
所以各物质的物质的量为B>C>A>D.
故选:B.
点评:考查常用化学计量的有关计算,难度不大,注意公式的运用与基础知识的掌握.
本题难度:一般
4、选择题 下列说法中正确的是
A.1L水中溶解了58.5g NaCl,该溶液的物质的量浓度为1mol/L
B.从1L 2mol/L的H2SO4溶液中取出0.5L,该溶液的浓度为1mol/L
C.配制500mL 0.5mol?L-1的CuSO4溶液,需62.5g胆矾
D.中和100mL 1mol/L的H2SO4溶液,需NaOH为4g
参考答案:C
本题解析:分析:A、水的体积不等于溶液的体积;
B、从1L2mol/L的H2SO4溶液中取出0.5L,该溶液的浓度不变;
C、先计算出胆矾的物质的量,再计算质量;
D、根据H++OH-=H2O计算.
解答:A、水的密度与NaCl溶液的密度不等,则配制后溶液的体积不等于1L,故A错误;
B、溶液为均一的混合物,从1L2mol/L的H2SO4溶液中取出0.5L,该溶液的浓度不变,故B错误;
C、胆矾的物质的量为0.5L×0.5mol/L=0.25mol,质量为0.25mol×250g/mol=62.5g,故C正确;
D、根据H++OH-=H2O,需要NaOH的物质的量为0.1L×1mol/L×2=0.2mol,质量为0.2mol×40g/mol=8g,故D错误.
故选C.
点评:本题考查物质的量浓度的计算,题目难度不大,注意水的密度与NaCl溶液的密度不等,水的体积不等于溶液的体积.
本题难度:一般
5、选择题 质量分数为n的NaOH溶液,其物质的量浓度为amol/L,加热蒸发水使其质量分数变为2n,此时,该溶液中的物质的量浓度为bmol/L,则a与b的关系正确的是
A.b>2a
B.b<2a
C.b=2a
D.a=2b
参考答案:A
本题解析:分析:氢氧化钠溶液浓度越大密度越大,令质量分数为n的NaOH溶液的密度为xg/ml,质量分数为2n的NaOH溶液的密度为yg/ml,根据c=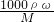 表示质量分数为n的NaOH溶液及质量分数为2n的NaOH溶液的物质的量浓度,据此结合密度x<y判断.
表示质量分数为n的NaOH溶液及质量分数为2n的NaOH溶液的物质的量浓度,据此结合密度x<y判断.
解答:令质量分数为n的NaOH溶液的密度为xg/ml,质量分数为2n的NaOH溶液的密度为yg/ml,则:
质量分数为n的NaOH溶液的物质的量浓度为a=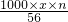 mol/L;
mol/L;
质量分数为2n的NaOH溶液的物质的量浓度为b= mol/L,
mol/L,
氢氧化钠溶液浓度越大,密度越大,所以x<y,故b>2a.
故选A.
点评:本题考查物质的量浓度计算、物质的量浓度与质量分数关系等,难度不大,理解物质的量浓度定义.
本题难度:简单