1、选择题 下列不符合当今化学研究方向的是
[? ]
A.发现新物质
B.合成新材料
C.研究化学反应的微观过程
D.研究化学反应中原子守恒关系
2、填空题 (8分)碘化钠是实验室中常用的分析试剂,工业上用铁屑还原法制备NaI的流程如下图:
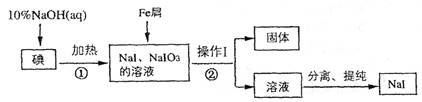
请回答下列问题:
(1) 判断反应①中碘是否反应完全的方法是_____________________
(2) 操作I的名称是_____________________;
(3) 反应①的离子方程式为_____________________
(4) 反应②中NaIO3被Fe单质还原为NaI,同时生成Fe(OH)3,该反应的化学方程式是______;
在该反应中若有99 g NaIO3被还原,则转移电子的物质的量为_______mol
3、实验题 (17分) FeSO4?7H2O广泛用于医药和工业领域。
以下是FeSO4?7H2O的实验室制备流程图。
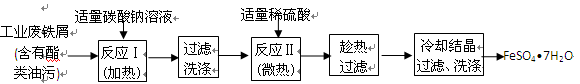
根据题意完成下列填空:
(1)碳酸钠溶液能除去酯类油污,是因为?(用离子方程式表示),反应Ⅰ需要加热数分钟,其原因是?。
(2)废铁屑中含氧化铁,无需在制备前除去,理由是?
(用离子方程式回答)?,?。
(3)判断反应Ⅱ完成的现象是:?。
以下是测定某补血剂(FeSO4?7H2O)中铁元素含量的流程图。根据题意完成下列填空:

(4)步骤Ⅲ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及?。写出步骤Ⅳ的离子方程式:?。
(5)步骤Ⅴ一系列操作依次是:①过滤②洗涤③?④冷却⑤称量⑥恒重操作。操作⑥的目的是?。
(6)假设实验无损耗,则每片补血剂含铁元素的质量?g(用含a的代数式表示)。
4、填空题 海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图:
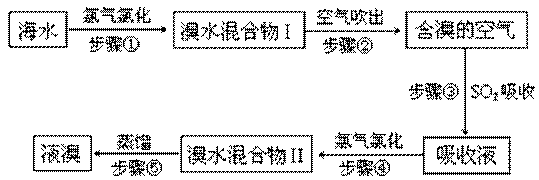
(1)步骤①反应的离子方程式是?。
(2)步骤③反应的化学方程式是?。
(3)Br的原子序数是?,在周期表中位于?周期?族。
(4)步骤⑤蒸馏的过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:
(5)为什么不直接用“溴水混合物I”而要用“溴水混合物II”进行蒸馏,得到液溴?
5、填空题 (1)有机化学的研究范围包括________。
(2) 1830年,德国化学家___________创立了有机化合物的 _____________。
(3)有机化学还能破译并合成___________,认识并改变_____________,从分子水平上揭示生命的奥秘。