1、选择题 下列不符合当今化学研究方向的是
[? ]
A.发现新物质
B.合成新材料
C.研究化学反应的微观过程
D.研究化学反应中原子守恒关系
参考答案:D
本题解析:
本题难度:简单
2、填空题 (8分)碘化钠是实验室中常用的分析试剂,工业上用铁屑还原法制备NaI的流程如下图:
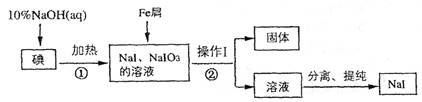
请回答下列问题:
(1) 判断反应①中碘是否反应完全的方法是_____________________
(2) 操作I的名称是_____________________;
(3) 反应①的离子方程式为_____________________
(4) 反应②中NaIO3被Fe单质还原为NaI,同时生成Fe(OH)3,该反应的化学方程式是______;
在该反应中若有99 g NaIO3被还原,则转移电子的物质的量为_______mol
参考答案:(8分)(1)取少量反应后的溶液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已反应完全;反之,碘未反应完全。(1分)(或取少量反应后的溶液于试管中,滴入几滴CCl4,振荡、静置,若下层液体呈无色,证明碘已反应完全;若下层液体呈紫红色,证明碘未反应完全。)?
(2)过滤(1分)?(3)3I2 + 6OH-=5I-+ IO3-+ 3H2O?(2分)
(4)2Fe+ NaIO3+ 3H2O=2Fe(OH)3↓+NaI (2分)? 3(2分)
本题解析:本题考查工业流程有关知识。(1)单质碘遇淀粉变蓝,因此可用淀粉溶液检验。也可采用萃取的方法,将碘单质萃取出来。看萃取剂中的颜色。即取少量反应后的溶液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已反应完全;反之,碘未反应完全(或取少量反应后的溶液于试管中,滴入几滴CCl4,振荡、静置,若下层液体呈无色,证明碘已反应完全;若下层液体呈紫红色,证明碘未反应完全)。(2)从流程图看,操作I的名称后面得到的是固体和溶液,故操作I的名称是过滤。(3)从反应前后可以看出,反应物为NaOH和I2,产物为NaI和NaIO3,故反应的离子方程式为3I2 + 6OH-=5I-+ IO3-+ 3H2O;(4)NaIO3被Fe单质还原为NaI,同时生成Fe(OH)3,该反应的化学方程式是2Fe+ NaIO3+ 3H2O=2Fe(OH)3↓+NaI,从方程式前后化合价的升降来看,在该反应中若有99 g NaIO3(即0.5mol)被还原为NaI(得到6mol电子),则转移电子的物质的量为3mol
本题难度:一般
3、实验题 (17分) FeSO4?7H2O广泛用于医药和工业领域。
以下是FeSO4?7H2O的实验室制备流程图。
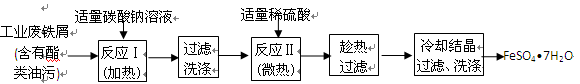
根据题意完成下列填空:
(1)碳酸钠溶液能除去酯类油污,是因为?(用离子方程式表示),反应Ⅰ需要加热数分钟,其原因是?。
(2)废铁屑中含氧化铁,无需在制备前除去,理由是?
(用离子方程式回答)?,?。
(3)判断反应Ⅱ完成的现象是:?。
以下是测定某补血剂(FeSO4?7H2O)中铁元素含量的流程图。根据题意完成下列填空:

(4)步骤Ⅲ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及?。写出步骤Ⅳ的离子方程式:?。
(5)步骤Ⅴ一系列操作依次是:①过滤②洗涤③?④冷却⑤称量⑥恒重操作。操作⑥的目的是?。
(6)假设实验无损耗,则每片补血剂含铁元素的质量?g(用含a的代数式表示)。
参考答案:(1)CO32—+H2O HCO3—+2OH—;(2分)
HCO3—+2OH—;(2分)
升温,促进水解,溶液碱性增强,使反应充分进行。(2分)
(2)Fe2O3 +6H+→2Fe3++3H2O,(2分)?2Fe3+ +Fe→3Fe2+?(1分)
(3)铁粉不再溶解,铁粉表面不再有气泡产生?(2分)?
(4)100mL容量瓶(1分)? Fe3++3OH—→Fe(OH)3↓(合理即可)?(2分)
(5)③灼烧(加热)(1分)?
⑥恒重操作确保氢氧化铁完全分解成了氧化铁?(2分)?
(6)0.07a(2分)
本题解析:本题分为两部分,第一部分为工艺流程问题,第二部分为定量实验问题。(1)读懂流程,了解每步加入什么物质,发生什么反应,如何进行分离。①碳酸钠水解呈碱性,可促使含酯类油污发生水解出去,通过过滤、洗涤等手段等得到纯净的废铁屑;②加入酸以后,铁及铁的氧化物反应,得到Fe2+、Fe3+,且如果有Fe3+,铁单质将其还原为Fe2+,然后通过过滤的方法,得到纯净的FeSO4溶液;③通过冷却结晶,过滤洗涤得到纯净的FeSO4·7H2O晶体。(2)通过溶解、氧化、沉淀,将铁元素全部转化为Fe2O3,从而确定其质量。m(Fe)=a×="0.7a" g,每片为0.07ag。
本题难度:一般
4、填空题 海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图:
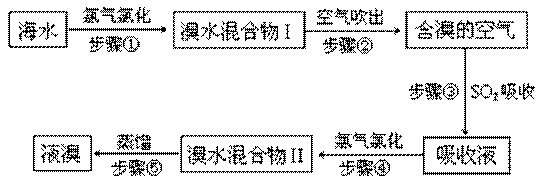
(1)步骤①反应的离子方程式是?。
(2)步骤③反应的化学方程式是?。
(3)Br的原子序数是?,在周期表中位于?周期?族。
(4)步骤⑤蒸馏的过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:
(5)为什么不直接用“溴水混合物I”而要用“溴水混合物II”进行蒸馏,得到液溴?
参考答案:
(1) 2Br- + Cl2══Br2 + 2Cl- ?(3分)?(2) SO2 + Br2 + H2O══2HBr + H2SO4 (3分)
(3)35?第四?第VIIA (3分)
(4)温度过高,大量水蒸汽随溴排出,溴气中水增加,温度过低,溴不能完全蒸出,回收率低。(3分)
(5)“溴水混合物I”中虽然含有溴单质,但浓度低,如果直接蒸馏,处理量大,生产成本高;经过“空气吹出、SO2吸收、氯化”等步骤实际上是将溴水浓缩了。(3分)
本题解析:略
本题难度:简单
5、填空题 (1)有机化学的研究范围包括________。
(2) 1830年,德国化学家___________创立了有机化合物的 _____________。
(3)有机化学还能破译并合成___________,认识并改变_____________,从分子水平上揭示生命的奥秘。
参考答案:(1)有机物的来源、结构、性质、合成、应用及有关理论和方法等
(2)李比希;定量分析方法
(3)蛋白质;遗传分子
本题解析:
本题难度:一般