1、填空题 (7分)NO2溶于水生成HNO3和NO,工业上利用这一反应原理制取HNO3 。
3NO2+H2O=2HNO3+NO?(第一次吸收)
但这一步NO2的吸收率只有2/3,还余下1/3的NO。为了更多地吸收NO2,工业上通常把生成的NO再次氧化为NO2,再次用水吸收
2NO+O2=2NO2?(第一次通O2)
3NO2+H2O=2HNO3+NO?(第二次吸收)
如此循环,可以使NO2全部转化为HNO3 。
现有3升NO2,如果按上述方法进行循环氧化吸收:
(1)则第二次吸收后,NO2的总吸收百分率为?(可以用分数表示,下同),第二次通入O2的体积为?升,第三次吸收后还剩余NO?升。
(2)第n次吸收后剩余NO的体积为?升(用含n的代数式表示)。
(3)如果要使3升N O2恰好完全转化为HNO3,则需通入O2的总体积为?升。
O2恰好完全转化为HNO3,则需通入O2的总体积为?升。
(所有气 体体积均在相同条件下测定)
体体积均在相同条件下测定)
参考答案:(10分)(1)8/9,? 1/6?,? 1/9?。?(2)? 1/(3n-1)。?(3)3/4。
本题解析:略
本题难度:一般
2、填空题 A、B、C、D、E是五种中学化学常见的单质,已知A、B、C、D在常温下均为气态。其中D能分别跟A、B、C在一定条件下两两化合,生成化合物X、Y、Z;A与B、C均不能直接化合。有关的转化关系如下图所示(反应条件均已略去)。
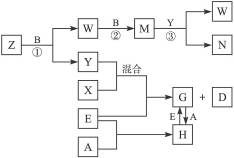
完成下列问题:
(1)Z分子的空间构型为_________。
(2)反应③中被氧化的物质与被还原物质的物质的量之比为_________。
(3)Z和W在催化剂作用下,反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为___________________________。
(4)将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×1023个,则参加反应的E的质量为_________g。
(5)将Z与N反应后的产物溶于水中,则溶液的pH_________(填“<”或“>”)7,其原因是(用离子方程式表示)_________________。
参考答案:(1)三角锥形 ?(2)2∶1
(3)4NH3+6NO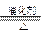 5N2+6H2O
5N2+6H2O
(4)14
(5)<?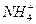 +H2O
+H2O NH3·H2O+H+
NH3·H2O+H+
本题解析:A、B、C、D在常温下是气体单质,常见的气体单质只有H2、N2、O2、F2、Cl2五种,其中D能分别跟A、B、C在一定条件下两两化合,可推出D为H2,那么对应的氢化物可为NH3、H2O、HF(或者HCl)。由Y+X+E G+H2,可知E为金属,又因为G
G+H2,可知E为金属,又因为G H,所以E为变价金属Fe,那么Y+X应为常见的盐酸,那么A为Cl2,X为HCl,C为N2,Z为NH3,空间构型为三角锥形。B为O2,Y为H2O,W为NO,M为NO2,NO2+H2O====2HNO3+NO,所以被氧化的物质与被还原物质的物质的量之比为2∶1。过量的Fe和HNO3反应生成Fe2+,所以参加反应的Fe为0.25 mol,即为14 g。Z与N反应后的产物为NH4NO3溶液,溶液显酸性的原因是:
H,所以E为变价金属Fe,那么Y+X应为常见的盐酸,那么A为Cl2,X为HCl,C为N2,Z为NH3,空间构型为三角锥形。B为O2,Y为H2O,W为NO,M为NO2,NO2+H2O====2HNO3+NO,所以被氧化的物质与被还原物质的物质的量之比为2∶1。过量的Fe和HNO3反应生成Fe2+,所以参加反应的Fe为0.25 mol,即为14 g。Z与N反应后的产物为NH4NO3溶液,溶液显酸性的原因是: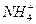 +H2O
+H2O NH3·H2O+H+。
NH3·H2O+H+。
本题难度:简单
3、选择题 若2 mol Mg跟5 mol HNO3恰好完全反应,则在该反应中的稀硝酸被还原成为
A.NO2
B.NO
C.N2O
D.N2
参考答案:C
本题解析:略
本题难度:简单
4、实验题 已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐热分解的反应方程式如下(条件都是加热):
①2KNO3=2KNO2+O2↑
②2Cu(NO3)2=2CuO+4NO2↑+O2↑
③2AgNO3=2Ag+2NO2↑+O2↑
今有某固体可能由上述三种硝酸盐中的一种或几种组成。取适量该固体充分加热,得到一定量的气体,将这些气体通入水中,结果全部被吸收,没有剩余,回答:
(1)该固体是否可能只由一种盐组成?若可能,指出是哪种盐,若不可能,说明原因。___________________________________________________________________________________.
(2)若固体是混合物,指出它的可能组成(即物质的量之比),若没有这种组成,也请说明__________________________________________________________________________________。
参考答案:(1)可能,Cu(NO3)2分解所得NO2、O2物质的量之比为4:1,通入水中发生反应:4NO2+O2+2H2O=4HNO3,全部吸收。
(2)没有这种组成。由(1)可知,只有当NO2、O2物质的量之比为4:1时才可能被完全吸收,若为混合物,则不可能出现4:1的情况,因此不会有这种组成.
本题解析:附:另有一种题型---……若该气体经水充分吸收后,剩余气体的体积在同温同压下为吸收前的1/6,(后面问题相同)
---答:
(1)可能;AgNO3.
(2)KNO3和Cu(NO3)2物质的量之比为1:1;
或者由三种盐组成,其中KNO3和Cu(NO3)2物质的量之比为1:1,而AgNO3物质的量是任意的。
本题难度:简单
5、选择题 工业上用废铜屑作原料制备硝酸铜。为了节约原料和防止污染环境,宜采用的方法是(? )
A.Cu + HNO3(浓) → Cu(NO3)2
B.Cu +HNO3(稀) → Cu(NO3)2
C.Cu CuO
CuO  Cu(NO3)2
Cu(NO3)2
D.Cu  CuO
CuO 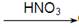 Cu(NO3)2
Cu(NO3)2
参考答案:C
本题解析:根据反应的方程式可知,选项ABD中都能产生大气污染物NO2、NO、SO2,C中没有污染物产生,且原料利用率高,所以正确的答案选C。
本题难度:一般