1、填空题 (7分)NO2溶于水生成HNO3和NO,工业上利用这一反应原理制取HNO3 。
3NO2+H2O=2HNO3+NO?(第一次吸收)
但这一步NO2的吸收率只有2/3,还余下1/3的NO。为了更多地吸收NO2,工业上通常把生成的NO再次氧化为NO2,再次用水吸收
2NO+O2=2NO2?(第一次通O2)
3NO2+H2O=2HNO3+NO?(第二次吸收)
如此循环,可以使NO2全部转化为HNO3 。
现有3升NO2,如果按上述方法进行循环氧化吸收:
(1)则第二次吸收后,NO2的总吸收百分率为?(可以用分数表示,下同),第二次通入O2的体积为?升,第三次吸收后还剩余NO?升。
(2)第n次吸收后剩余NO的体积为?升(用含n的代数式表示)。
(3)如果要使3升N O2恰好完全转化为HNO3,则需通入O2的总体积为?升。
O2恰好完全转化为HNO3,则需通入O2的总体积为?升。
(所有气 体体积均在相同条件下测定)
体体积均在相同条件下测定)
2、填空题 A、B、C、D、E是五种中学化学常见的单质,已知A、B、C、D在常温下均为气态。其中D能分别跟A、B、C在一定条件下两两化合,生成化合物X、Y、Z;A与B、C均不能直接化合。有关的转化关系如下图所示(反应条件均已略去)。
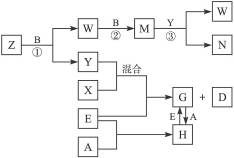
完成下列问题:
(1)Z分子的空间构型为_________。
(2)反应③中被氧化的物质与被还原物质的物质的量之比为_________。
(3)Z和W在催化剂作用下,反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为___________________________。
(4)将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×1023个,则参加反应的E的质量为_________g。
(5)将Z与N反应后的产物溶于水中,则溶液的pH_________(填“<”或“>”)7,其原因是(用离子方程式表示)_________________。
3、选择题 若2 mol Mg跟5 mol HNO3恰好完全反应,则在该反应中的稀硝酸被还原成为
A.NO2
B.NO
C.N2O
D.N2
4、实验题 已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐热分解的反应方程式如下(条件都是加热):
①2KNO3=2KNO2+O2↑
②2Cu(NO3)2=2CuO+4NO2↑+O2↑
③2AgNO3=2Ag+2NO2↑+O2↑
今有某固体可能由上述三种硝酸盐中的一种或几种组成。取适量该固体充分加热,得到一定量的气体,将这些气体通入水中,结果全部被吸收,没有剩余,回答:
(1)该固体是否可能只由一种盐组成?若可能,指出是哪种盐,若不可能,说明原因。___________________________________________________________________________________.
(2)若固体是混合物,指出它的可能组成(即物质的量之比),若没有这种组成,也请说明__________________________________________________________________________________。
5、选择题 工业上用废铜屑作原料制备硝酸铜。为了节约原料和防止污染环境,宜采用的方法是(? )
A.Cu + HNO3(浓) → Cu(NO3)2
B.Cu +HNO3(稀) → Cu(NO3)2
C.Cu CuO
CuO  Cu(NO3)2
Cu(NO3)2
D.Cu  CuO
CuO 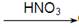 Cu(NO3)2
Cu(NO3)2