|
高考化学知识点总结《磷及其化合物》在线测试(2019年最新版)(八)
2019-06-28 21:57:15
【 大 中 小】
|
1、选择题 14 mL二氧化氮和氨的混合气体在一定条件下充分反应,化学方程式是6NO2+8NH3====7N2+12H2O。已知该混合气体参加反应的二氧化氮比参加反应的氨少2 mL(气体体积均在相同状况下测定),则原混合气体中二氧化氮和氨的物质的量之比是(?)
A.3∶2
B.2∶3
C.3∶7
D.3∶4
参考答案:D
本题解析:用差量法计算较为简单。
6NO2? +? 8NH3====7N2+12H2O? ΔV
6? 8? 2
6 mL?8 mL? 2 mL
参加反应的NO2、NH3分别为6 mL、8 mL。
6 mL+8 mL="14" mL,NO2与NH3均无剩余。
则n(NO2)∶n(NH3)="6" mL∶8 mL=3∶4。
本题难度:简单
2、填空题 【化学—选修2:化学与技术】(15分)
I、污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质不能作为沉淀剂的是
A.氨水
B.硫化氢气体
C.硫酸钠溶液
D.纯碱溶液
| II、合成氨的流程示意图如下:
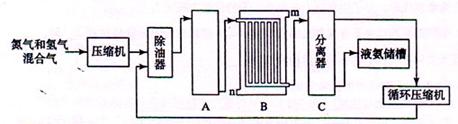
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是?,?;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式?,
?;
(2) 设备A中含有电加热器、触煤和热交换器,设备A的名称?,其中发生的化学反应方程式为?;
(3) 设备B的名称?,其中m和n是两个通水口,入水口是?(填“m”或“n”)。不宜从相反方向通水的原因?;
(4) 设备C的作用?;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g) ?CO2 (g)+ H2 (g) ,?已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于?。 ?CO2 (g)+ H2 (g) ,?已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于?。
参考答案:Ⅰ、AC (2分)
Ⅱ、(1) 液化、分馏 ; (1分)?与碳反应除去CO2?(1分)
 (1分)? (1分)? ?(1分) ?(1分)
(2) 合成塔? (1分) (1分) (1分)
(3)冷却塔?(1分)? n (1分)
高温气体由冷却塔的上端进入,冷却水从下端进入,逆向冷却效果好。(2分)
(4)将液氨与未反应的原料气分离。 (1分)
(5)13.8? (2分)
本题解析:I.过量氨水与Cu2+反应生成[Cu(NH3)2]2+、硫酸钠溶液与Cu2+不反应。
Ⅱ⑴从空气中分离出氮气的方法:①先通过降温将空气液化,然后再升温分馏得氮气,②将空气与碳反应,然后再除去CO2得氮气;C、CH4均能与水蒸气反应制取氢气。
⑵工业上合成氨( )的设备为合成塔; )的设备为合成塔;
⑶从合成塔出来的混合气(N2、H2、NH3)通过冷却塔使氨气冷凝从混合气中分离出来;冷却水要从下口(n)进入,高温气体由冷却塔的上端进入,实现逆向冷却效果好。
⑷设备C能将液氨与未反应的原料气分离出来,同时再将未反应的原料气压缩到合成塔中循环利用。
⑸据题意,要使反应正向进行(除去CO),则 ,解得 ,解得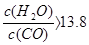 。 。
本题难度:一般
3、选择题 将3.84g铜粉加入到80mL lmol·L-1的稀硝酸溶液中,充分反应后,再向溶液中加入下列物质,充分搅拌后,铜粉仍然不能完全溶解的是
A.80mL l mol·L-1的稀硝酸溶液
B.80mL 0.5mol·L-1的稀盐酸
C.80mL lmnl·L-1的FeCI3溶液
D.80mL 0.5mol·L-l的稀硫酸溶液
参考答案:B
本题解析:3.84g铜粉的物质的量为0.06mol,80mL lmol·L-1的稀硝酸的物质的量为0.08mol;铜与稀硝酸反应的离子方程式为: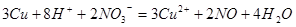 由方程式可得,铜完全溶解需氢离子物质的量为0.16mol;硝酸根离子物质的量为0.04mol,所以可得氢离子的物质的量不够,还需氢离子0.08mol;A正确,80mL l mol·L-1的稀硝酸溶液中氢离子物质的量为0.08mol;B错,80mL 0.5mol·L-1的稀盐酸中氢离子的物质的量为0.04mol;C正确,铁离子与铜反应的离子方程式为: 由方程式可得,铜完全溶解需氢离子物质的量为0.16mol;硝酸根离子物质的量为0.04mol,所以可得氢离子的物质的量不够,还需氢离子0.08mol;A正确,80mL l mol·L-1的稀硝酸溶液中氢离子物质的量为0.08mol;B错,80mL 0.5mol·L-1的稀盐酸中氢离子的物质的量为0.04mol;C正确,铁离子与铜反应的离子方程式为: ,剩余0.08mol铜需消耗铁离子的物质的量为0.06mol;80mL lmnl·L-1的FeCI3溶液中铁离子的物质的量为0.08mol;D正确,80mL 0.5mol·L-l的稀硫酸溶液氢离子的物质的量为0.08mol; ,剩余0.08mol铜需消耗铁离子的物质的量为0.06mol;80mL lmnl·L-1的FeCI3溶液中铁离子的物质的量为0.08mol;D正确,80mL 0.5mol·L-l的稀硫酸溶液氢离子的物质的量为0.08mol;
本题难度:一般
4、实验题 实验室里若用下图装置制取氨气,请指出图中存在的问题,并简要说明如何改正。
存在问题:
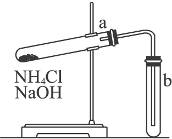
改正方法:
参考答案:错误之处:①所用试剂,②试管a的管口方向,③试管b管口向上,④反应条件,⑤试管b塞上橡皮塞。
改正方法:①将NaOH换成Ca(OH)2,②管口略向下倾斜,③应向下,④用酒精灯加热,⑤换成棉花团。
本题解析:判断气体实验装置是否有错误,一般主要看:发生装置、试剂使用、实验原理、收集方法、实验安全(如尾气处理,是否引起爆炸、飞溅等)五方面是否有误。
本题难度:简单
5、选择题 鉴别NO2和溴蒸气的方法可选用 …(?)
A.通入蒸馏水中观察颜色变化
B.通入AgNO3溶液中观察沉淀的生成
C.用湿润的淀粉碘化钾试纸接近气体
D.分别通入NaOH溶液观察颜色变化
参考答案:AB
本题解析:Br2(g)通入水中,仍有颜色,通入AgNO3(aq)中会生成淡黄色沉淀;NO2也可使湿润的淀粉碘化钾试纸变蓝,NO2和Br2(g)遇NaOH都呈无色。
本题难度:简单
| 
 ?CO2 (g)+ H2 (g) ,?已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于?。
?CO2 (g)+ H2 (g) ,?已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于?。