1、选择题 下列物质的沸点逐渐升高的是
A.NH3 PH3 AsH3 SbH3
B.Si SiC H2O CO2
C.NaI NaBr NaCl NaF
D.Li Na K Rb
参考答案:C
本题解析:A、在NH3分子间存在氢键,所以其沸点最高。错误。B、Si 和SiC属于原子晶体,由于键长Si—Si>Si—C,所以沸点Si<SiC ;而 H2O 和CO2都是分子晶体,分子间以分子间作用力结合,在水的分子间还存在氢键。所以沸点H2O <CO2,对于不同的晶体来说沸点规律是:原子晶体>离子晶体>分子晶体。错误。C、它们都是离子晶体,离子间通过离子键结合,由于离子半径I-> Br-> Cl-> F-.离子半径越大,离子键就越弱,该物质的沸点就越低。所以沸点NaI < NaBr < NaCl < NaF。正确。D、都是碱金属,由于从上到下原子半径逐渐增大,所以原子间的作用力就作用逐渐减弱,熔沸点逐渐降低。错误。
本题难度:一般
2、选择题 下列说法正确的是
A.高熔点的固体如果不是离子晶体,则一定为原子晶体
B.由盐酸的酸性强于氢硫酸的酸性,可推知氧化性:Cl2>S
C.由两种元素组成的共价化合物分子中,只可能存在极性键
D.若X+ 和Y2-的核外电子层结构相同,则原子序数:X>Y
参考答案:D
本题解析:A、金属晶体的熔点有的也非常高,如金属钨,错误;B、不能用氢化物水溶液的酸性强弱来判断单质氧化性的强弱,错误;C、由两种元素组成的共价化合物分子中,还可能存在非极性键,如H2O2,错误;D、若X+ 和Y2-的核外电子层结构相同,根据阴上阳下的原则,Y在上一周期,X在下一周期,所以原子序数:X>Y,正确,答案选D。
本题难度:一般
3、选择题 短周期主族元素A、B、C、D原子序数依次增大。A、C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是?
A.原子半径:A<B<C<D? B.C单质在常温下为气态
C.D单质在工业上的用途之一是制漂白粉? D.B的氧化物为碱性氧化物
参考答案:C
本题解析:依题意可知A为氧B为铝C为硫D为氯,原子半径:B>C>D >A,C单质在常温下为固态,B的氧化物为两性氧化物。
本题难度:一般
4、填空题 用A+、B-、C2-、D、E、F、G分别表示含有18个电子的七种微粒(离子或分子),请回答:
(1)A元素是________、B元素是________、C元素是________(用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其分子式是________。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是________。
(4)F是由两种元素组成的三原子分子,其分子式是________,电子式是________,分子构型为________,属于________分子(填“极性”或“非极性”)。
(5)G分子中含有8个原子,其分子式为________,其中心原子的杂化方式为________,分子中含有________个σ键。
参考答案:(12分)(1)K Cl S? (2)HCl (3)F2 (4)H2S 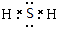 V形 极性 (5)C2H6 sp3杂化 7
V形 极性 (5)C2H6 sp3杂化 7
本题解析:(1)A+、B-、C2-、D、E、F、G分别表示含有18个电子的七种微粒,则A是K,B是Cl,C是S。
(2)D是由两种元素组成的双原子分子,则分子式是HCl。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,则分子式是F2。
(4)F是由两种元素组成的三原子分子,则F是H2S,电子式是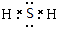 。其中中心原子含有的孤对电子对数是(6-2×1)÷2=2,所以是V形结构,属于极性分子。
。其中中心原子含有的孤对电子对数是(6-2×1)÷2=2,所以是V形结构,属于极性分子。
(5)G分子中含有8个原子,则该物质是乙烷,其分子式为C2H6。碳原子是饱和碳原子,则中心原子的杂化轨道类型是sp3杂化。单键都是σ键,属于分子中含有7个σ键。
点评:该题是中等难度的试题,试题基础性强,侧重对学生能力的培养和解题方法的指导与训练。该题的关键是熟练记住常见的18电子微粒,然后结合题意灵活运用即可,有利于培养学生的逻辑推理和抽象思维能力,提高学生的应试能力和学习效率。
本题难度:一般
5、选择题 对符号 的理解正确的是:(?)
的理解正确的是:(?)
A. X元素的一种原子的相对原子质量是A
B. X元素的一种原子的质子数是A
C. X元素的一种原子的质量数是Z
D. X元素的一种原子的原子核内中子数是A — Z
参考答案:D
本题解析:A为相对原子质量的整数值,质子数为Z,中子数为A - Z,D正确。
本题难度:简单