1、计算题 取一定量的CuO粉末与0.5L稀硫酸充分反应后,将一根50g铁棒插入上述溶液中,至铁棒质量不再变化时,铁棒增重0.24g. 并收集到224mL气体(标准状况)。求此CuO粉末的质量。
参考答案:8 g
g
本题解析:由题意可知,CuO粉末与稀硫酸充分反应后,硫酸过量。
引起铁棒质量变化时涉及到下列两个反应:
① Fe? +? H2SO4? ="?" FeSO4? + H2
② Fe? +? CuSO4? ="?" FeSO4? + Cu
其中第①个反应使铁棒质量减少,第②个反应使铁 棒质量增加,两者的代数和为0.24g。
棒质量增加,两者的代数和为0.24g。
① Fe? +? H2 SO4? ="?" FeSO4? + H2?△m1
SO4? ="?" FeSO4? + H2?△m1
56g? 1mol? 56g?
0.01mol? 0.56g
△?m2?-△m1 =" 0.24g.?" △m2=△m1 +0.24g="0.56g+0.24g=0.80g"
设CuO的物质的量为x, CuSO4的物质的量也为x,
② Fe? +? CuSO4? ="?" FeSO4? + Cu?△m2
1mol? 8g
X? 0.80g
解得: X=0.1mol
m(CuO)= 0.1mol?80g/mol=8 g
g
本题难度:简单
2、填空题 (6分)铁及其化合物之间的相互转化可用下式表示:

回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液实现上述①的转化,要求产物纯净。可选用的试剂是?(选填序号);
a.Cl2? b.Fe? c.HNO3? d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+===Cu2++5Fe2++2S(CuFeS2中S为-2价)。
则下列说法正确的是?(选填序号);
a.从物质的组成来看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1 mol e-?时,有46 g CuFeS2参加反应
(3)高铁酸钾是一种新型、高效的绿色净水剂,其净水原理是??。
参考答案:(6分)
(1)d(2分)?(2)d(2分)
(3)高铁酸钾具有强氧化性,可以杀菌、消毒(1分),同时生成的Fe3+离子转化为Fe(OH)3胶体,能加速悬浮物沉降,起净化作用(1分)。
本题解析:(1)要使产物纯净,必须物质间发生反应后,没有杂质生成。A项有氯离子杂质生成,错误;b项铁与稀硫酸反应生成二价铁离子,不能把二价铁离子转化为三价铁离子,错误;c项硝酸能氧化二价铁离子生成三价铁离子,但溶液中还有杂质硝酸根离子,错误;d项双氧水能氧化二价铁离子生成三价铁离子,同时有水生成,水是原溶液的成分,所以不是杂质,正确。故选d。
(2)a项合金是由两种或两种以上的金属与非金属经一定方法所合成的具有金属特性的物质,所以黄铜矿不是合金,错误;b项CuFeS2中铁元素的化合价为+2价,生成物中Fe2+的化合价为+2价,所以不是所有铁元素均被还原,错误;c项CuFeS2中只有S元素的化合价只有降低,其他元素的化合价不变,所以CuFeS2只作还原剂,错误;d项根据反应CuFeS2+4Fe3+=Cu2++5Fe2++2S,在这个反应中转移4mol电子,生成184g?CuFeS2。则转移1 mol e-?时,有? 46g?CuFeS2参加反应。故d正确。
(3)高铁酸钾( K2FeO4)中Fe的化合价是+6价,具有强氧化性,能杀菌消毒,其还原产物Fe3+水解生成氢氧化铁胶体,能吸附水中杂质,所以高铁酸钾作为水处理剂发挥的作用是净水、消毒。
点评:本题考查了铁盐和亚铁盐的相互转化,难度不大,注意二价铁离子和三价铁离子的检验是高考的热点,三价铁离子能使KSCN变红色。
本题难度:一般
3、选择题 下列陈述和判断均正确,且有因果关系的是(? )
选项
| 陈述
| 判断
|
A
| Si有良好的半导体性能
| Si可用于制备光导纤维
|
B
| 在未知溶液中加入稀硝酸和氯化钡溶液有沉淀生成
| 说明该未知溶液含有SO42-
|
C
| 铁、铜、汞、银的金属活动性顺序为Fe>(H)>Cu>Hg>Ag
| 要从矿石中冶炼得到金属单质,铁和铜必须用还原剂,汞和银只需加热
|
D
| 锌锰干电池碳棒是正极,MnO2是氧化剂
| 锌锰干电池是二次电池,可以反复充电
参考答案:C
本题解析:单质硅是很好的半导体材料,但是制备光导纤维的是其氧化物二氧化硅,A错误;用氧化性强的硝酸酸化氯化钡溶液,不能排除SO32- 的干扰,因此B判断错误;C中陈述I陈述的金属的活动性顺序正确,由于金属活动性越强,越难制备得到,因此结合实际金属的制备情况,从陈述I可以找到与陈述II之间的因果关系,C正确;锌锰干电池是普通的一次电池,D陈述错误;故选C。
本题难度:简单
4、填空题 某研究性学习小组利用下列原料和流程制备CuSO4·5H2O。
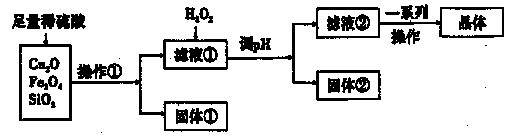
已知:Cu+在酸性条件下不稳定,易生成金属Cu和Cu2+。
(1)操作①的名称为____。?,
(2)若固体①的成分为混合物,则其成分的化学式为____。
(3)将H2O2加入滤液①中,发生反应的离子方程式为?。
(4)调pH可选用的药品为____。
A.NaOH溶液
B.CuO
C.氨水
D.CuCO3
|
(5)获得的CuSO4·5H2O晶体表面附着杂质离子,常用酒精洗涤的原因是?。
参考答案:⑴过滤(1分)⑵SiO2、Cu(2分答错0分,答不全1分,下同)⑶2Fe2++H2O2+2H+=2Fe3++2H2O⑷B? D (2分)⑸减少CuSO4·5H2O晶体的损失。(2分)
本题解析:Cu2O+H2SO4=CuSO4+Cu+H2O,生成蓝色溶液和红色物质铜,Fe3O4与硫酸反应生成Fe2(SO4)3和FeSO4,Fe3+ 要与部分Cu反应,SiO2不与H2SO4反应,⑴操作①为过滤,将不溶于酸的SiO2和末反应的铜分离出去,故答案:⑴过滤(1分)⑵SiO2、Cu;⑶将H2O2加入滤液①中,将Fe2+ 氧化成Fe3+ 便于用水解的方法分离,2Fe2++H2O2+2H+=2Fe3++2H2O,答案:2Fe2++H2O2+2H+=2Fe3++2H2O;⑷Fe3+ 沉淀的pH为1.1-3.2,可以用CuO和CuCO3调pH,促进Fe3++3H2O Fe(OH)3+3H+ 水解平衡向正向移动,不用NaOH,NH3·H2O,生成Na2SO4,(NH4)2SO4难以除去,答案:B D;⑸酒精分子极性校小,CuSO4·5H2O晶体在其中的溶解度小,减少CuSO4·5H2O晶体的损失,提高产率。答案:减少CuSO4·5H2O晶体的损失,提高产率。
Fe(OH)3+3H+ 水解平衡向正向移动,不用NaOH,NH3·H2O,生成Na2SO4,(NH4)2SO4难以除去,答案:B D;⑸酒精分子极性校小,CuSO4·5H2O晶体在其中的溶解度小,减少CuSO4·5H2O晶体的损失,提高产率。答案:减少CuSO4·5H2O晶体的损失,提高产率。
考点:实验探究、铜及其化合物
本题难度:一般
5、填空题 【化学一选修2:化学与技术】(15分)
利用硫酸工业废渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
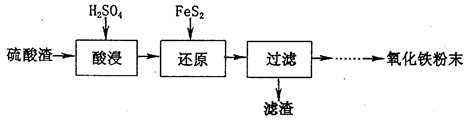
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②__________________。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO ,该反应的离子方程式为____________.
,该反应的离子方程式为____________.
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。
实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-===2Fe2++SnCl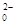
Sn2++4Cl-+2HgCl2="==" SnCl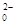 +Hg2Cl2↓
+Hg2Cl2↓
6Fe2++ Cr2O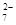 +14H+===6Fe3++2Cr3++7H2O
+14H+===6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量__________(填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量偏高,其原因是_____________。
(4)①可选用______________(填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是_________________(用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的,pH见下表:
沉淀物
| Fe(OH)3
| Fe(OH)2
| Al(OH)3
| Mg(OH)2
| Mn(OH)2
|
开始沉淀
| 2.3
| 7.5
| 3.4
| 9.4
| 8.3
|
完全沉淀
| 3.2
| 9.7
| 4.4
| 12.4
| 9.8
|
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化:________________________________;b.沉淀:_____________________________;
c.分离,洗涤;d.烘干,研磨。
参考答案:(1)抑制Fe3+的水解(2分)
(2)14Fe3++FeS2+8H2O ===15Fe2++2SO +16H+(2分)
+16H+(2分)
(3)①偏低,②若不加HgCl2,溶液中含有Sn2+,也可以被酸性高锰酸钾氧化,消耗的酸性高锰酸钾氧化偏大,则测定的Fe3+量偏高。(2分)
(4)①KSCN(2分);4Fe2++O2+4H+ ===4Fe3++H2O (2分);
②a.向溶液中加入过量的酸性高锰酸钾溶液,搅拌(2分);
b.滴加NaOH溶液,调节溶液的pH为3.2~3.8(2分)
本题解析:(1) 酸浸”中硫酸要适当过量,抑制Fe3+的水解;
(2)由信息Fe3+转化为Fe2+,同时FeS2被氧化为SO ,在利用氧化还原反应配平方程式:14Fe3++FeS2+8H2O ===15Fe2++2SO
,在利用氧化还原反应配平方程式:14Fe3++FeS2+8H2O ===15Fe2++2SO +16H+;
+16H+;
(3)①若SnCl2不足量,Fe3+没有完全还原为Fe2+,则测定的Fe3+量偏低,②若不加HgCl2,溶液中含有Sn2+,也可以被酸性高锰酸钾氧化,消耗的酸性高锰酸钾氧化偏大,则测定的Fe3+量偏高。
(4)①检验滤液中含有Fe3+是KSCN溶液;Fe2+的氧化反应是:4Fe2++O2+4H+ ===4Fe3++H2O;
②a.向溶液中加入过量的酸性高锰酸钾溶液,搅拌;b.滴加NaOH溶液,调节溶液的pH为3.2~3.8,使Fe3++完全沉淀。
本题难度:困难