1、计算题 取一定量的CuO粉末与0.5L稀硫酸充分反应后,将一根50g铁棒插入上述溶液中,至铁棒质量不再变化时,铁棒增重0.24g. 并收集到224mL气体(标准状况)。求此CuO粉末的质量。
2、填空题 (6分)铁及其化合物之间的相互转化可用下式表示:

回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液实现上述①的转化,要求产物纯净。可选用的试剂是?(选填序号);
a.Cl2? b.Fe? c.HNO3? d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+===Cu2++5Fe2++2S(CuFeS2中S为-2价)。
则下列说法正确的是?(选填序号);
a.从物质的组成来看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1 mol e-?时,有46 g CuFeS2参加反应
(3)高铁酸钾是一种新型、高效的绿色净水剂,其净水原理是??。
3、选择题 下列陈述和判断均正确,且有因果关系的是(? )
选项
| 陈述
| 判断
|
A
| Si有良好的半导体性能
| Si可用于制备光导纤维
|
B
| 在未知溶液中加入稀硝酸和氯化钡溶液有沉淀生成
| 说明该未知溶液含有SO42-
|
C
| 铁、铜、汞、银的金属活动性顺序为Fe>(H)>Cu>Hg>Ag
| 要从矿石中冶炼得到金属单质,铁和铜必须用还原剂,汞和银只需加热
|
D
| 锌锰干电池碳棒是正极,MnO2是氧化剂
| 锌锰干电池是二次电池,可以反复充电
4、填空题 某研究性学习小组利用下列原料和流程制备CuSO4·5H2O。
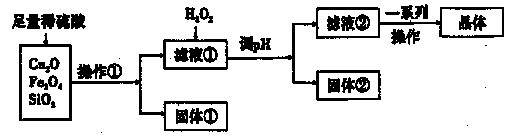
已知:Cu+在酸性条件下不稳定,易生成金属Cu和Cu2+。
(1)操作①的名称为____。?,
(2)若固体①的成分为混合物,则其成分的化学式为____。
(3)将H2O2加入滤液①中,发生反应的离子方程式为?。
(4)调pH可选用的药品为____。
A.NaOH溶液
B.CuO
C.氨水
D.CuCO3
|
(5)获得的CuSO4·5H2O晶体表面附着杂质离子,常用酒精洗涤的原因是?。
5、填空题 【化学一选修2:化学与技术】(15分)
利用硫酸工业废渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
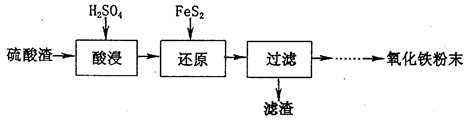
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②__________________。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO ,该反应的离子方程式为____________.
,该反应的离子方程式为____________.
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。
实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-===2Fe2++SnCl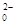
Sn2++4Cl-+2HgCl2="==" SnCl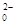 +Hg2Cl2↓
+Hg2Cl2↓
6Fe2++ Cr2O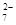 +14H+===6Fe3++2Cr3++7H2O
+14H+===6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量__________(填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量偏高,其原因是_____________。
(4)①可选用______________(填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是_________________(用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的,pH见下表:
沉淀物
| Fe(OH)3
| Fe(OH)2
| Al(OH)3
| Mg(OH)2
| Mn(OH)2
|
开始沉淀
| 2.3
| 7.5
| 3.4
| 9.4
| 8.3
|
完全沉淀
| 3.2
| 9.7
| 4.4
| 12.4
| 9.8
|
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化:________________________________;b.沉淀:_____________________________;
c.分离,洗涤;d.烘干,研磨。