1、选择题 基态氮原子的电子排布为1s22s22p3,则氮原子的p轨道上三个电子的排布式为
[? ]
A.
B.
C.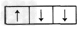
D.
参考答案:A
本题解析:
本题难度:简单
2、填空题 ?A.乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1) CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为____; 1 mol O22+中含有的π键数目为____。
(2)将乙炔通入[ Cu( NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为____。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C三N)。丙烯腈分子中碳原子轨道杂化类型是____;分子中处于同一直线上的原子数目最多为____
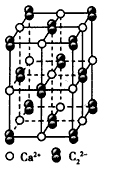
?(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如下图所示),但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22- 数目为____。
?
B.对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。
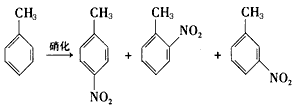
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4 为催化剂(可循环使用),在CCl4溶剂中,加入乙酸酐(有脱水作用),45℃反应1h。反应结束后,过滤,滤液分别用5% NaHCO3溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(5)上述实验中过滤的目的是____。
(6)滤液在分液漏斗中洗涤静置后,有机层处于___层(填“上”或“下”); 放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有_______________
(7)下表给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
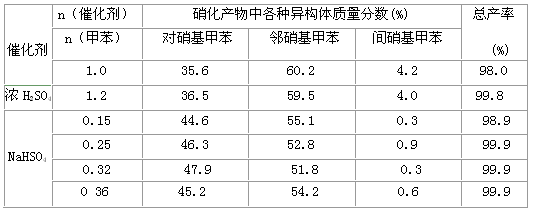
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为______
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是_______
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有______、______
参考答案:
(1)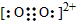 ;2NA
;2NA
(2)1s22s22p63s23p63d10
(3)sp杂化、sp2 杂化; 3
(4)4?
(5)同收NaHSO4
(6)下;分液漏斗上口塞子未打开
(7)①0.32; ②甲苯硝化主要得到对硝基甲苯和邻硝基甲苯;③在硝化产物中对硝基甲苯比例提高;催化剂用量少且能循环使用(合理答案均可)
本题解析:
本题难度:一般
3、选择题 当镁原子由1s22s22p63s2→1s22s22p63p2时,以下认识正确的是( )
A.镁原子由基态转化成激发态,这一过程中吸收能量
B.镁原子由激发态转化成基态,这一过程中释放能量
C.转化后位于p能级上的两个电子处于同一轨道,且自旋方向相同
D.转化后镁原子与硅原子电子层结构相同,化学性质相似
参考答案:A
本题解析:
本题难度:简单
4、填空题 (三选一)【选修3:物质结构与性质】
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为___________。
(2)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________
(3)甲醛(结构式为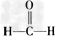 )与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
)与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醛分子中碳原子轨道的杂化类型为_____________;甲醛分子的空间构型是___________;1mol甲醛分子中含σ键的数目为________________________。
②在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为___________________。
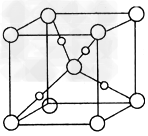
参考答案:(1)1s22s22p63s23p63d9或[Ar]3d9
(2)N、 F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F原子,偏离N原子使得N原子核对其孤对电子的吸引能力增强,难与Cu2+形成配位键
(3)①sp2杂化;平面三角形;3NA;②4
本题解析:
本题难度:一般
5、填空题 氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是_________________。
(2)C、N、O三种元素第一电离能从大到小的顺序是____________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是_______________;N2H4分子中氮原子轨道的杂化类型是___________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1 若该反应中有4mol N-H键断裂,则形成的π键有________mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__________(填标号)
a. 离子键 b. 共价键 c. 配位键 d. 范德华力
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。
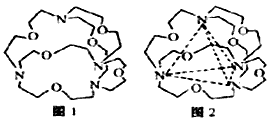
下列分子或离子中,能被该有机化合物识别的是_________(填标号)。
a. CF4 b. CH4 c. NH4+ d. H2O
参考答案:(1)2s22p3
(2)N>O>C
(3)①三角锥型;sp3;②3;③d
(4)c
本题解析:
本题难度:一般