1、选择题 下列离子方程式一定正确的是
[? ]
A.镁与一定浓度的硝酸反应:3Mg +8H+ +2NO3-= 3Mg2+ +2NO↑+4H2O
B.纯碱的水解:CO32-+2H2O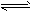 H2CO3+2OH-
H2CO3+2OH-
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl- Cl2↑+Mn2+ +H2O
Cl2↑+Mn2+ +H2O
D.Ca(HCO3)2溶液与澄清石灰水反应:Ca2++HCO3-+OH-=CaCO3↓+H2O
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列各组离子可能大量共存的是
A.pH=1的溶液中: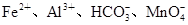
B.能与金属铝反应放出氢气的溶液中:
C.含有大量OH-的无色溶液中:
D.常温下水电离出的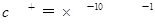 的溶液中:
的溶液中: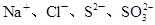
参考答案:D
本题解析:A项pH=1的溶液中含有大量H+,HCO3-不能大量存在,而且Fe2+和H+、MnO4-能发生氧化还原反应而不能共存,A错误;B项能与金属铝反应放出氢气的溶液可能是酸性溶液也可能是碱性溶液,在碱性溶液中NH4+不能大量存在, B错误;C项要求无色溶液,Cu2+显蓝色,C错误;D项常温下水电离出的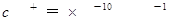 的溶液可能是酸性溶液也可能是碱性溶液,在酸性中S2-、SO32-不能大量存在,但在碱性条件下可以共存。
的溶液可能是酸性溶液也可能是碱性溶液,在酸性中S2-、SO32-不能大量存在,但在碱性条件下可以共存。
点评:注意附加条件的综合分析
本题难度:一般
3、选择题 能正确表示下列反应的离子方程式是( )
A.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
B.向漂白粉溶液中通人SO2气体:Ca2++2C1O-+SO2=CaSO3↓+2HC1O
C.向小苏打溶液中加入醋酸:HCO3-+CH3COOH=CO2↑+H2O+CH3COO-
D.稀硝酸中加入过量铜片:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
参考答案:A、苯酚钠溶液中通入少量CO2的离子方程式为:C6H5O-+CO2+H2O→C6H5OH+HCO3-,故A错误;
B、二氧化硫被次氯酸氧化为硫酸,故B错误;
C、向小苏打溶液中加入醋酸反应的离子方程式为:HCO3-+CH3COOH=CO2↑+H2O+CH3COO-,故C正确;
D、稀硝酸中加入过量铜片:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故D正确;
故选CD.
本题解析:
本题难度:一般
4、简答题 在200mL稀硫酸和稀盐酸的混合溶液中,加入5.13g?Ba(OH)2粉末,充分反应后过滤,得沉淀2.33g;又测知反应后的溶液中OH-的物质的量浓度为0.1mol-L-1.试求混合酸溶液中Cl-和SO42-的物质的量浓度.(假设反应前后溶液的总体积不变)
参考答案:沉淀2.33g为硫酸钡的质量,则
n(SO42-)=n(H2SO4)=n(BaSO4)=2.33g233g/mol=0.01mol,
所以SO42-浓度为0.01mol0.2L=0.05mol/L;
反应后的溶液中OH-的物质的量为0.2L×0.1mol/L=0.02mol,
Ba(OH)2的物质的量为5.13g171g/mol=0.03mol,
则酸中总的n(H+)=0.03mol×2-0.02mol=0.04mol,
n(Cl-)=(HCl)=0.04mol-2n(H2SO4)=0.04mol-2×0.01mol=0.02mol,
则Cl-浓度为0.02mol0.2L=0.1mol/L,
答:混合酸溶液中Cl-浓度为0.1mol/L,SO42-的物质的量浓度为0.05mol/L.
本题解析:
本题难度:一般
5、选择题 下列离子方程式书写正确的是( )
A.铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.碳酸氢铵溶液与足量氢氧化钠溶液反应:HCO
+OH-=CO+H2O
C.溴化亚铁溶液中通人足量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D.稀硫酸与氢氧化钡溶液反应:2H++2OH-+Ba2++SO=BaSO4↓+2H2O
参考答案:A.铁与盐酸反应的离子反应为Fe+2H+=Fe2++H2↑,故A错误;
B.碳酸氢铵溶液与足量氢氧化钠溶液反应的离子反应为NH4++HCO3-+2OH-=CO32-+NH3.H2O+H2O,故B错误;
C.溴化亚铁溶液中通人足量氯气的离子反应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故C错误;
D.稀硫酸与氢氧化钡溶液反应的离子反应为2H++2OH-+Ba2++SO42-=BaSO4↓+2H2O,故D正确;
故选D.
本题解析:
本题难度:一般