1、选择题 下列条件下化学反应速率最大的是( )
A.20℃0.1mol·L-1的盐酸溶液20 mL与0.5 g块状碳酸钙反应
B.10℃ 0.1mol·L-1的盐酸溶液20 mL与1 g块状碳酸钙反应
C.10℃ 0.2mol·L-1的盐酸溶液10mL与0.5g粉状碳酸钙反应
D.20℃ 0.2mol·L-1的盐酸溶液10mL与0.5g粉状碳酸钙反应
参考答案:D
本题解析:当其他条件不变时,增大反应物的浓度,增加反应物的接触面积,升高温度均能加快化学反应速率,据此判断选D。
本题难度:一般
2、填空题 (5分)某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)(2分)硫酸铜溶液可以加快氢气生成速率的原因 。
(2)(1分)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是 。
(3)(2分)要加快上述实验中气体产生的速率,还可采取的措施有(答两种): ; 。
参考答案:(1)CuSO4与Zn反应生成的Cu附着在Zn表面形成铜锌原电池加快了化学反应速率;
(2)Ag2SO4;
(3)适当增加硫酸的浓度;增加锌粒的表面积;升高温度等(答两种即可)。
本题解析:(1)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应生成的Cu附着在Zn表面形成铜锌原电池加快了化学反应速率。
(2)Ag2SO4与Zn反应生成的Ag附着在Zn表面形成银锌原电池加快了化学反应速率,所以与上述实验中CuSO4溶液起相似作用的是Ag2SO4;
(3)根据影响化学反应速率的因素可知,要加快上述实验中气体产生的速率,还可采取的措施有:适当增加硫酸的浓度;增加锌粒的表面积;升高温度等。
考点:理解外界条件(浓度、温度、压强、催化剂等)对反应速率的影响,认识并能用相关理论解释其一般规律。
点评:本题考查了影响化学反应速率的因素,特别是原电池对化学反应速率的影响。
本题难度:一般
3、填空题 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如右的坐标曲线来表示,回答下列问题:
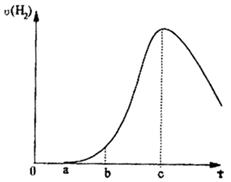
小题1:曲线由0→a段不产生氢气的原因____________________,
有关的离子方程式为___________________________;
小题2:曲线由a→b段产生氢气的速率较慢的原因________________;
小题3:曲线由b→c段,产生氢气的速率增加较快的主要原因___________;
小题4:曲线由c以后,产生氢气的速率逐渐下降的主要原因____________。
参考答案:
小题1:铝片表面有氧化铝,硫酸首先与表面的氧化铝反应;
Al2O3 + 6H+ = 2Al3+ + 3H2O;
小题2:开始时,硫酸与铝片只有部分作用,溶液温度低;
小题3:反应放出的热量使溶液的温度升高而加快反应速率;
小题4:随着反应的进行,硫酸溶液浓度下降。
本题解析:
小题1:铝属于活泼的金属,其表面被氧化生成了一层致密的氧化铝,所以投入到硫酸中,硫酸首先与表面的氧化铝反应,然后再和单质铝反应生成氢气,反应式为Al2O3 + 6H+ = 2Al3+ + 3H2O。
小题2:由于开始反应时溶液的温度比较低,反应速率就慢。
小题3:因为铝和硫酸反应属于放热反应,随着反应的进行,溶液的温度逐渐升高,所以反应速率逐渐加快。
小题4:当反应进行到一定程度时硫酸的浓度降低,即此时浓度的影响超过了温度对反应速率的影响,所以反应速率要逐渐降低。
本题难度:一般
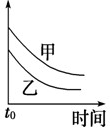
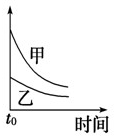
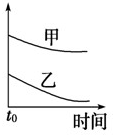
4、选择题 下列表格中的各种情况,可以用下面对应选项中的图象曲线表示的是( )
| 选项 | 反应 | 纵坐标 | 甲 | 乙
A
外形、大小相近的金属和水反应 | 反应速率
Mg
Na
B
4mL?0.01mol/L的KMnO4溶液,分别和不同浓度的H2C2O4(草酸)溶液各2mL反应
0.1mol/L的H2C2O4溶液
0.2mol/L的H2C2O4溶液
C
5mL?0.1mol/L?Na2S2O3溶液和5mL?0.1mol/L?H2SO4溶液反应
热水
冷水
D
5mL?4%的过氧化氢溶液分解放出O2
无MnO2粉末
加MnO2粉末
|
A.

B.
C.
D.
参考答案:A.Na比Mg活泼,反应速率快,则图象中乙应在上方,故A错误;
B.浓度大,反应速率快,则图象中乙应在上方,故B错误;
C.温度高,反应速率快,随反应的进行,正反应速率逐渐减小,甲的温度高,图中中应在上方,与图象一致,故C正确;
D.加催化剂,反应速率加快,则图中应乙在上上,故D错误;
故选C.
本题解析:
本题难度:简单
5、选择题 下列实验中,反应速率加快是由催化剂引起的是( )
A.在炭粉中加入KCl03,点燃时燃烧更为剧烈
B.H2O2中加入少量MnO2,即可迅速放出气体
C.将炭块粉碎成粉末状,可使燃烧更加充分
D.电解水时,加少量硫酸可使电解速率加快
参考答案:A.在炭粉中加入KCl03,点燃时燃烧更为剧烈,是因为氯酸钾分解产生氧气,增大了氧气的浓度,故反应速率加快,故A不符合;
B.H2O2中加入少量MnO2,即可迅速放出气体,是因为MnO2为催化剂,加快了过氧化氢的分解,故B符合;
C.将炭块粉碎成粉末状,可使燃烧更加充分,是增大了接触面积,反应速率加快,故C不符合;
D.电解水时,加少量硫酸可使电解速率加快是因为硫酸是强电解质能增强水的导电能力,故D不符合;
故选B
本题解析:
本题难度:一般