1、填空题 (8分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。
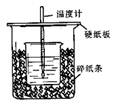
通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
参考答案:17.(8分)(1)环形玻璃搅拌棒 (2)减少实验过程中的热量损失。 (3)偏小
(4)不相等;相等;因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关
(5)偏小;
本题解析:(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,答案为:环形玻璃搅拌器;(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:减少实验过程中的热量损失,答案为:减少实验过程中的热量损失;(3)大烧杯上如不盖硬纸板,会导致热量散失,求得的中和热数值偏小;(4)反应放出的热量和所用酸以及碱的量的多少有关,若用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液反应,测得中和热数值相等,答案为:不相等;相等;因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关;(5)氨水为弱碱,电离过程为吸热过程,所以氨水代替NaOH溶液反应,反应放出的热量小于57.3kJ,答案为:偏小.
考点:考查中和热的测定。
本题难度:一般
2、选择题 根据化学反应的实质是旧键断裂新键形成这一现实,下列变化不属于化学反应的是( )
A.白磷在260℃时转化为红磷
B.石墨在高温下转化为金刚石
C.NaCl熔化
D.五氧化二磷吸水
参考答案:A、白磷在260℃时转化为红磷,既有旧化学键断裂,又有新化学键形成,故A不选;
B、石墨在高温下转化为金刚石,既有旧化学键断裂,又有新化学键形成,故B不选;
C、NaCl熔化属于物理过程,只存在旧键的断裂,没有新键生成,故C选;
D、五氧化二磷吸水生成磷酸,既有旧化学键断裂,又有新化学键形成,故D不选;
故选:C.
本题解析:
本题难度:一般
3、填空题 ①Ar ②CO2 ③KCl ?④NaOH四种物质中,只存在共价键的是?,(填序号,下同)只存在离子键的是?,既存在离子键,又存在共价键的是?,不存在化学键的是?。
参考答案:②;③;④;①
本题解析:考查化学键的判断。一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间形成共价键。稀有气体元素的最外层电子已经达到稳定结构,所以稀有气体分子中不存在化学键。
本题难度:一般
4、选择 题 下列离子方程式表达正确的是
A.SO2通入溴水中溴水褪色:SO2+2H2O+Br2=2H++SO42-+2HBr
B.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
C.NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
D.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
参考答案:C
本题解析:分析:A、HBr为强电解质,在水中完全电离;
B、漂白粉溶液在空气中失效应生成碳酸钙和次氯酸;
C、溶液呈中性时,氢离子与氢氧根离子恰好完全反应,则NaHSO4与Ba(OH)2物质的量之比为2:1;
D、Fe(OH)3溶于氢碘酸中应发生氧化还原反应.
解答:A、因HBr为强电解质,则正确的离子反应为SO2+2H2O+Br2=4H++SO42-+2Br-,故A错误;
B、漂白粉溶液在空气中失效应生成碳酸钙和次氯酸,则正确的离子反应为Ca2++2ClO-+CO2+H2O=2HClO+CaCO3↓,故B错误;
C、硫酸氢钠溶液中滴加氢氧化钡至中性时,硫酸氢钠与氢氧化钡的物质的量之比为2:1,其反应为2NaHSO4+Ba(OH)2=2H2O+Na2SO4+BaSO4↓,
离子反应为2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓,故C正确;
D、因铁离子具有氧化性,氢碘酸具有还原性,则正确的离子反应为2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O,故D错误;
故选C.
点评:本题考查离子反应方程式书写的正误判断,明确反应的实质是解答的关键,并注意强电解质的判断、溶液为中性、离子之间的氧化还原反应来解答即可.
本题难度:简单
5、选择题 热化学方程式中化学式前的化学计量数表示( )
A.分子个数
B.原子个数
C.物质的质量
D.物质的量