1、选择题 下列关于化学键的说法中不正确的是
A.化学键是一种作用力
B.化学键可以使离子相结合,也可以使原子相结合
C.分子间作用力又称范德华力,它属于化学键
D.化学反应过程中,反应物分子内的化学键断裂,生成物分子中的化学键形成
参考答案:C
本题解析:A、化学键是相邻原子之间的强烈的相互作用,故A正确;B、形成化学键的微粒可能是离子也可能是原子但不能是分子,故B正确;C、分子间作用力不属于化学键,故C不正确;D、化学反应的实质是有旧化学键的断裂和新化学键的形成,,故D正确,故选C。
本题难度:一般
2、实验题 (14分)有一包白色固体粉末,其中可能含有NaCl、Ba(NO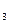 )
)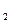 、CuSO
、CuSO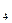 、Na
、Na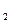 CO
CO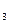 中的一种或几种,现做以下实验:
中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色。
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生。
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生。
④另取①中过滤后的溶液加入足量AgNO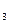 溶液,产生白色沉淀。
溶液,产生白色沉淀。
试根据上述实验事实,完成下列问题:
(1)原白色粉末中一定含有的物质是_____________,一定不含的物质是_______________,可能含有的物质是_________________。(以上各种物质均写化学式)
(2)写出各步变化可能的离子方程式。
参考答案:(1)Ba(NO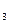 )
)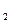 、Na
、Na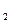 CO
CO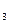 ?CuSO
?CuSO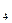 ?NaCl
?NaCl
(2)Ba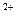 +CO
+CO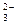
 BaCO
BaCO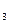 ↓
↓
BaCO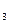 +2H
+2H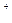
 Ba
Ba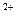 +CO
+CO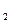 ↑+H
↑+H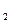 O
O
SO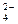 +Ba
+Ba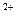
 BaSO
BaSO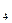 ↓
↓
CO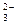 +2Ag
+2Ag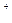
 Ag
Ag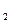 CO
CO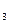 ↓
↓
Ag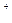 +Cl
+Cl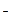
 AgCl↓
AgCl↓
本题解析:溶于水后形成的滤液呈无色,说明溶液中没有Cu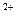 ,原粉末中肯定无CuSO
,原粉末中肯定无CuSO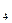 。沉淀物一定是BaCO
。沉淀物一定是BaCO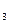 ,即原溶液中存在Ba
,即原溶液中存在Ba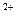 和CO
和CO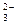 ,说明固体粉末中有Ba(NO
,说明固体粉末中有Ba(NO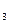 )
)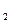 和Na2CO
和Na2CO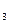 ;滤液与AgNO
;滤液与AgNO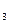 溶液作用产生白色沉淀,可能是AgCl沉淀,也可能是Ag2CO
溶液作用产生白色沉淀,可能是AgCl沉淀,也可能是Ag2CO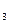 沉淀。
沉淀。
本题难度:一般
3、选择题 下列物质既含有离子键又含有共价键的是
A.H2O
B.Na2O
C.NH4Cl
D.N2
参考答案:C
本题解析:A.H2O只有共价键;B.Na2O只有离子键;C.NH4Cl中NH与Cl-之间是离子键、NH内部N与H之间是共价键;D.N2只有共价键。
本题难度:简单
4、选择题 下列说法正确的是( )
A.SiCl4、PCl5分子中各原子最外层均达到8电子稳定结构
B.化学反应中能量变化的大小与反应物的质量多少无关
C.经实验测得邻-二溴苯仅一种结构,说明苯环结构中,不存在单双键交替结构
D.需要加热才能发生的反应一定是吸热反应
参考答案:A.SiCl4中,Si最外层电子数为4,成键电子数为4,Cl的最外层电子数为7,成键电子数为1,都达到8电子稳定结构,PCl5分子中P原子最外层电子数为5,成键电子数为5,达到10电子结构,Cl的最外层电子数为7,成键电子数为1,达到8电子稳定结构,故A错误;
B.化学反应中能量变化的大小与反应物的物质的量、质量有关,质量越大,反应的能量变化越大,故B正确;
C.苯环中6个碳碳键完全相同,不存在单双建交替,邻-二溴苯仅一种结构,如实单双键交替,应有2种结构,故C正确;
D.反应的吸、放热与是否加热才能反应无关,如铝热反应为放热反应,但需要加热才能进行,故D错误.
故选C.
本题解析:
本题难度:一般
5、选择题 下列反应的离子方程式正确的是
A.铁片插入氯化铁溶液中:Fe3++Fe=2Fe2+
B.少量金属钠放到硫酸铜溶液中:Cu2++2Na=Cu+2Na+
C.少量金属钠放到冷水中:Na+2H2O=Na++OH-+H2↑
D.氢氧化铜加到盐酸中:Cu(OH)2+2H+=Cu2++2H2O
参考答案:D
本题解析:分析:A.电子、电荷不守恒;
B.反应生成氢氧化铜、氢气、硫酸钠;
C.没有配平;
D.反应生成氯化铜和水,氢氧化铜、水在离子反应中保留化学式.
解答:A.铁片插入氯化铁溶液中的离子反应为2Fe3++Fe=3Fe2+,故A错误;
B.少量金属钠放到硫酸铜溶液中的离子反应为2H2O+Cu2++2Na=Cu(OH)2↓+H2↑+2Na+,故B错误;
C.少量金属钠放到冷水中的离子反应为2Na+2H2O=2Na++2OH-+H2↑,故C错误;
D.氢氧化铜加到盐酸中的离子反应为Cu(OH)2+2H+=Cu2++2H2O,故D正确;
故选D.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意选项B为解答的难点和易错点,题目难度中等.
本题难度:一般