1、选择题 下列微粒中,最外层未成对电子数最多的是
A.O
B.P
C.Mn
D.Fe3+
参考答案:D
本题解析:略
本题难度:一般
2、填空题 下表中列出五种短周期元素A、B、C、D、E的信息,请推断后回答:
元素
| 有?关?信?息
|
A
| 元素主要化合价为-2,原子半径为0.074 nm
|
B
| 所在主族序数与所在周期序数之差为4
|
C
| 原子半径为0.102 nm,其单质为黄色晶体,可在A的单质中燃烧
|
D
| 最高价氧化物的水化物能按1︰1电离出电子数相等的阴、阳离子
|
E
| 原子半径为0.075 nm,最高价氧化物的水化物可与其氢化物形成一种盐X
|
?
(1)写出C元素在周期表中的位置 ?,写出D元素最高价氧化物的水化物电子式 ?;
(2)写出B单质与水反应的离子方程式?;
(3)元素A和D形成的某种化合物可作为呼吸面具中氧气的来源,写出得到氧气反应的主要化学方程式?;
(4)X的水溶液显 (填“酸”、“碱”或“中”)性,用离子方程式解释其原因是 ?;
(5)已知E元素的某种氢化物Y与A2的摩尔质量相同,Y与空气组成的燃料电池中,电解质溶液是30%的KOH溶液,该电池放电时正极的电极反应式为?;
(6)若使用Y—空气燃料电池精炼铜,当得到精铜80 g时,燃料电池中转移的电子数为?NA。
参考答案:(1)第三周期 VIA族;?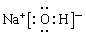 ;
;
(2)Cl2 + H2O Cl-+ H+ + HClO?;
Cl-+ H+ + HClO?;
(3)2Na2O2 + 2CO2 ="=" 2Na2CO3 + O2?;
(4)酸; ?NH4++ H2O NH3·H2O + H+?;
NH3·H2O + H+?;
(5)O2+2H2O+4e- ="=" 4OH-?;
(6)2.5?。
本题解析:根据题意可知这几种元素分别是A是O;B是Cl;C是S;D是Na;E是N。X是NH4NO3。(1)S元素在周期表中位于第三周期 VIA族。Na元素最高价氧化物的水化物NaOH的电子式为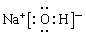 。(2)Cl2与水反应的两种方程式为:Cl2+H2O
。(2)Cl2与水反应的两种方程式为:Cl2+H2O H++Cl-+HClO。(3)元素O和Na形成的化合物Na2O2可作为呼吸面具中氧气的来源,该反应的化学方程式为2Na2O2 + 2CO2 ="=" 2Na2CO3 + O2。(4)X NH4NO3是强酸弱碱盐,在溶液中存在水解平衡:NH4++ H2O
H++Cl-+HClO。(3)元素O和Na形成的化合物Na2O2可作为呼吸面具中氧气的来源,该反应的化学方程式为2Na2O2 + 2CO2 ="=" 2Na2CO3 + O2。(4)X NH4NO3是强酸弱碱盐,在溶液中存在水解平衡:NH4++ H2O NH3·H2O + H+,消耗了水电离产生的OH-,使OH-的浓度减小,促进了水的电离,当最终达到电离平衡时,由于溶液中c(OH-)<c(H+).所以其水溶液显酸性。(5)O2的相对分子质量为32,与其等式量的N的氢化物的化学式为N2H4,俗称联氨。燃料N2H4与空气组成的燃料电池中,燃料N2H4为负极,空气的电极为正极。电解质溶液是30%的KOH溶液,则该电池放电时的正极电极反应式为O2+2H2O+4e- ="=" 4OH- 。(6)在整个闭合回路中电子转移的物质的量相等。若使用Y—空气燃料电池精炼铜,当得到精铜80 g时,n(Cu)=80g÷64g/mol=1.25mol,所以n(e-)=2.5mol.即燃料电池中转移的电子数N=2.5NA。
NH3·H2O + H+,消耗了水电离产生的OH-,使OH-的浓度减小,促进了水的电离,当最终达到电离平衡时,由于溶液中c(OH-)<c(H+).所以其水溶液显酸性。(5)O2的相对分子质量为32,与其等式量的N的氢化物的化学式为N2H4,俗称联氨。燃料N2H4与空气组成的燃料电池中,燃料N2H4为负极,空气的电极为正极。电解质溶液是30%的KOH溶液,则该电池放电时的正极电极反应式为O2+2H2O+4e- ="=" 4OH- 。(6)在整个闭合回路中电子转移的物质的量相等。若使用Y—空气燃料电池精炼铜,当得到精铜80 g时,n(Cu)=80g÷64g/mol=1.25mol,所以n(e-)=2.5mol.即燃料电池中转移的电子数N=2.5NA。
本题难度:一般
3、填空题 (10分)短周期元素A、B、C、D它们的原子序数依次增大。其中A、C与B、D分别是同主族元素。又知B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数和的2倍。这四种元素的单质中有2种气体,2种固体。(以下均用该元素的实际符号表示)
(1)写出元素符号:A?;D?;
(2)写出A、B、C、三种元素形成的化合物的电子式?;
(3)用电子式表示A和D组成的化合物的形成过程?;
(4)写出由两种均含A、B、C、D四种元素的化合物相互反应,产生气体的化学方程式?。
参考答案:(1)H? S
(2)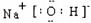
(3)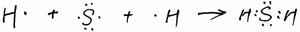
(4)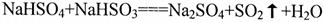
本题解析:略
本题难度:简单
4、选择题 某元素的电离能(电子伏特)如下表:
I1
| I2
| I3
| I4
| I5
| I6
| I7
|
14.5
| 29.6
| 47.4
| 77.5
| 97.9
| 551.9
| 666.8
|
此元素位于元素周期表的族数是( )
A.ⅠA? B.ⅢA?C.ⅤA ?D.ⅦA
参考答案:C
本题解析:失去第五个电子后很难再失去电子,为第五主族的元素。
本题难度:简单
5、填空题 X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W相邻;
②X分别与Y、Z、W可组成化学式为YX3,X2Z和X2W三种共价化合物
请填空:
(1)X、Y、Z原子最外层电子数之和是________
(2)X2W的结构式是________
(3)X、Y和Z组成的一种化合物是强酸.写出该酸的稀溶液与铜反应的离子方程式:
________________________________________________________________________
含Y、Z的气体和一种只含X、Z的液体(在常温、常压下)反应可以生成一种离子化合物其化学式为________
(4)X、Y、Z和W组成一种化合物,其原子个数之比为5∶1∶3∶1;该化合物具有
还原性。
① 写出该化合物与过量稀NaOH溶液反应的离子方程式:
________________________________________________________________________.
② 请设计实验证明该化合物具有还原性:
________________________________________________________________________。
参考答案:(9分) (1)12(1分)(2)H—?—H(1分)
(3)3Cu+ 8H++2NO=3Cu2++2NO↑+4H2O(2分) NH4NO3或NH4NO2(1分)
(4) ①NH+HSO+2OH-=NH3·H2O+H2O+SO(2分)
②取少许氯水,滴加该溶液,氯水褪色则说明该化合物具有还原性(KMnO4、溴水、
Fe3+等均可) (2分)
本题解析:X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W相邻;②X分别与Y、Z、W可组成化学式为YX3,X2Z和X2W三种共价化合物。这说明Y、Z是第二周期元素,W是第三周期元素。因此X是H,则Y是N,Z是O、W是S。
(1)X、Y、Z原子最外层电子数之和是1+5+6=12。
(2)H2S的结构和水的结构相似,则H2S的结构式是H—?—H。
(3)X、Y和Z组成的一种化合物是强酸,则该强酸是硝酸。硝酸具有强氧化性,能和铜发生氧化还原反应,则硝酸的稀溶液与铜反应的离子方程式3Cu+ 8H++2NO=3Cu2++2NO↑+4H2O。含H、N、O三种元素的一种离子化合物的化学式为NH4NO3或NH4NO2。
(4)①X、Y、Z和W组成一种化合物,其原子个数之比为5∶1∶3∶1,则该化合物是NH4HSO3,与过量稀NaOH溶液反应的离子方程式是NH+HSO+2OH-=NH3·H2O+H2O+SO。
②+4价的S元素具有还原性,所以验证其还原性的实验方法是取少许氯水,滴加该溶液,氯水褪色则说明该化合物具有还原性。
点评:该题是中等难度的试题,试题贴近高考,基础性强,在注重对学生基础知识检验和训练的同时,侧重对学生能力的培养,有利于培养学生的逻辑推理能力和发散思维能力。准确判断出元素是答题的关键。
本题难度:一般