| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《反应速率与平衡的有关计算》试题巩固(2019年最新版)(十)
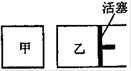 参考答案:(1)CO32-+H2O 本题解析:(1)土壤呈碱性的原因是由于CO32-和HCO3的水解产生了OH―,其离子方程式为: 本题难度:困难 4、选择题 有A、B两个起始容积相等的恒温密闭容器,A保持恒压,B保持恒容.起始时向A、B中均通入2molSO2和1molO2后,在一定条件下反应达到平衡.则下列说法中不正确的是 参考答案:BCD 本题解析:2SO2+O2 本题难度:一般 5、选择题 对于3Fe(s)+4H2O(g) 参考答案:D 本题解析:略 本题难度:简单 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《氨气》高频.. | |