1、选择题 A、B、C均为短周期元素,A、B同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法中正确的是
A.C元素的最高正价为+7价
B.原子半径:A>B>C
C.还原性:A2-D.离子半径:A2->C->B2+
参考答案:D
本题解析:试题分析:根据题干信息课推测,A是S,B是Mg,C是F。A不正确, F元素没有正价;B不正确,原子半径是B>A> C;C不正确,A元素的非金属性弱于C的,还原性则是A2->C-,所以正确的答案选D。
考点:考查元素周期表的结构和元素周期律的应用
点评:该题是高考中的常见题型,属于中等难度的试题,试题注重基础,侧重能力的培养。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:简单
2、选择题 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。X、Y也是短周期主族元素,且X+、Y2-的核外电子排布相同。下列说法错误的是
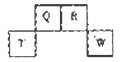
A.非金属性:Q B.Q、R、W三种元素的常见单质中所含微粒间的作用力完全相同
C.原子半径:X>T;离子半径:X+D.T单质能与X的最高价氧化物的水化物反应
参考答案:B
本题解析:结合四短周期元素Q、R、T、W的相对位置及“T所处的周期序数与主族序数相等”可推断出T元素为铝,进而可知Q、R、W分别为C、N、S元素;再根据Y2-所带电荷可判定Y为VIA元素,必为O,X则必为Na。
A.由S及C的最高价含氧酸的酸性硫酸大于碳酸,可知非金属性C<S,正确
B.C、N、S的常见单质分别为金刚石(石墨)、氮气、硫磺,微粒间的作用力分别为化学键、分子间力、分子间力。
C.微粒半径大小比较的规律是:电子层数越大半径越大,如果电子层数相同,核电荷数越大半径越小,故原子半径Na>Al,离子半径:Na+<O2-
D.铝可与钠的最高价氧化物的水化物NaOH反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
故答案为B
本题难度:困难
3、选择题 下列物质中不存在共价键的是
A.金刚石
B.氩气
C.硫磺
D.硝酸铵
参考答案:B
本题解析:氩气是单原子物质,原子间属于分子间力。
本题难度:困难
4、选择题 下列分子结构中,原子的最外层电子能都满足8电子稳定结构的是
A.CH4
B.PF3
C.SF6
D.BeCl2
参考答案:B
本题解析:原子的最外层电子数及其化合价的绝对值之和如果等于8,即满足8电子稳定结构,答案为B
本题难度:简单
5、选择题 A、B是短周期元素,两元素能形成B2A离子化合物,B+离子比A2-离子少一个电子层,已知A的原子序数为n,则元素B的原子序数是
A.n-5
B.n-6
C.n-13
D.n+13
参考答案:A
本题解析:由于B+离子比A2-离子少一个电子层,则元素A、B为同周期元素,利用这一点,即可通过排除法找到答案。
若B的原子序数取(B)、(C)、(D)的数值时,A、B不在同一周期,与题意不符,故(B)、(C)、(D)不可选。当元素B的原子序数为n-5时,A、B在同一周期,故选A。
本题难度:一般