| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《难溶电解质的溶解平衡》典型例题(八)
参考答案:D 本题解析:曲线图中从左到右依次表示②中和滴定过程、①平衡移动过程、③沉淀的生成和溶解、④固体物质的溶解度变化过程,选D。 本题难度:一般 2、选择题 下列有关物质检验的实验结论正确的是
(2)孔雀石的主要成分与足量稀硫酸反应的化学方程式为 。 (3)使用上图中“试剂1”的目的是将溶液中的Fe2+转化为Fe3+,试剂B宜选用 (填选项序号)。 A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水 (4)加入CuO作用是调节溶液pH,使Fe3+转化为沉淀予以分离。则pH的范围为 。 (5)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中,其中,应先通入气体是 (填代号及对应物质的化学式)。 (6)由溶液C获得CuCl2·3H2O,需要经过 、 、过滤等操作。 (7)已知:常温下Cu(OH)2的Ksp=2×10-20。计算Cu2++2H2O 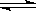 Cu(OH)2+2H+反应平衡常数 。 Cu(OH)2+2H+反应平衡常数 。 参考答案:(14分) 本题解析:(1)固体研磨是为了增大固体表面积,从而增大反应速率。(2)碱式碳酸铜和硫酸反应生成硫酸铜和水和二氧化碳,方程式为:Cu2(OH)2CO3+2H2SO4===2CuSO4+3H2O+CO2↑。(3)亚铁离子氧化成铁离子,尽量不引入新的元素,所以选择双氧水,选B。(4)调节溶液的pH使铁离子完全沉淀,但铜离子还没有开始沉淀,所以pH的范围为:3.2≤pH<4.7。(5)气体E、F与饱和食盐水作用生成H和G,最后得到碳酸钠,说明是侯式制碱法,需要通入氨气和二氧化碳,应先通入氨气,增加溶液的碱性,吸收更多的二氧化碳,得到更多的产物。(6)从氯化铜溶液中得到氯化铜晶体,所以需要先蒸发浓缩,然后冷却结晶。(7)平衡常数为[Cu(OH)2][H+]2/[Cu2+]=[Cu(OH)2][H+]2[OH-]2/[Cu2+][OH-]2=KW2/Ksp=10-28/2×10-20=5×10-9。 本题难度:困难 5、选择题 在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是 参考答案:D 本题解析:根据图中c点的c(Ag+)和c(Br-)可得该温度下AgBr的Ksp为 Ksp=4.9×10-13,A正确。在AgBr饱和溶液中加入NaBr固体后,c(Br-)增大,溶解平衡逆向移动,c(Ag+)减小,故B错。在a点时Qc< Ksp,故B错。故为AgBr的不饱和溶液,C正确。选项D中 本题难度:一般 |
|||||||||||||||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《化学反应与.. | |