1、填空题 某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

(1)操作①的名称是?,操作②的名称是?。
(2)试剂a是?,试剂b是?,固体B是?。(填化学式)
(3)加入试剂a所发生的化学反应方程式为:?。
加入试剂b所发生的化学反应方程式为:?。
(4)该方案能否达到实验目的:?。若不能,应如何改进(若能,此问不用回答)?。
(5)若要测定原混合物中KCl和BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是?(填“A”、“A1”、“B”、“C”)的质量。
参考答案:(1)操作①的名称是溶解(溶于水均可),操作②的名称是过滤(滤字写错不得分)。
(2)试剂a是)K2CO3,试剂b是HCl,固体B是BaCl2?。(填化学式)
(3)加入试剂a所发生的化学反应方程式为:K2CO3 +BaCl2=BaCO3↓+2KCl。
加入试剂b所发生的化学反应方程式为:BaCO3+2HCl= BaCl2+CO2↑+H2O。
(4)该方案能否达到实验目的:否(不能)。若不能,应如何改进(若能,此问不用回答)应在滤液中加入过量盐酸后再蒸发结晶(只要答到“在滤液中加入盐酸”即可)。
(5)若要测定原混合物中KCl和BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是沉淀A1或固体B (填“A”、“A1”、“B”、“C”)的质量。
本题解析:略
本题难度:简单
2、选择题 下列实验能获得成功的是
A.用溴水鉴别苯、乙醇、己烯、四氯化碳
B.加浓溴水,后过滤除去苯中少量苯酚
C.苯、溴水、铁粉混合制成溴苯
D.可用分液漏斗分离溴乙烷和甲苯
参考答案:A
本题解析:苯、四氯化碳和溴水发生萃取,有机层分别在上层和下层。乙醇和溴水互溶,己烯和溴水发生加成反应,A可以鉴别;B中生成的三溴苯酚能够溶解在苯中,并能除去,B错误;C不正确,应该用液溴;溴乙烷和甲苯互溶,并能直接分液,D不正确,答案选A。
点评:把物质中混有的杂质除去而获得纯净物叫提纯,将相互混在一起的不同物质彼此分开而得到相应组分的各纯净物叫分离。在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
本题难度:简单
3、实验题 某铝合金中含有合金元素镁、铜、硅,为了测定该合金中铝的含量,设计如下实验方案,请回答有关问题:
(1)称取样品a g,称量时应该使用的仪器名称是_________。
(2)将样品溶于足量的稀盐酸,过滤,溶液中主要含有________,滤渣中含有_______。
(3)滤液中加入过量的NaOH溶液,过滤。所得滤渣的化学式为_________。
(4)往步骤(3)的滤液中通入足量的CO2气体,过滤。反应的离子方程式为_________。
(5)步骤(4)过滤所得的滤渣用蒸馏水洗涤3次,烘干后高温灼烧至质量不再减轻为止,称得其质量为b g,则原样品中铝的质量分数为_________(用a、b表示)。
参考答案:(1)托盘天平(1分)?(2)MgCl2、AlCl3? Cu、Si(各1分)
(3)Mg(OH)2(1分)
(4)AlO +CO2+2H2O====Al(OH)3↓+HCO
+CO2+2H2O====Al(OH)3↓+HCO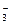 (3分)
(3分)
(5)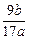 ×100%(3分)
×100%(3分)
本题解析:由题意可知,用托盘天平称取的a g样品在实验操作中完成了如下转换关系:

所以样品中Al的质量分数为:
 ×100%=
×100%=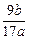 ×100%
×100%
本题难度:一般
4、选择题 实验室有一瓶购置时间较长绿矾(FeSO4?7H2O),老师将其交给化学研究小组某同学检验药品是否有变质现象,这位同学取绿矾做了简单的检验,得出的结论是:已经开始氧化.该同学所用的试剂和判断依据是( )
| 选项 | A | B | C | D
试剂
氯水
氢氧化钠溶液
铁屑
KSCN溶液
现象
出现黄褐色
最终生成红褐色沉淀
绿色
有较浅的血红色
|
A.A
B.B
C.C
D.D
参考答案:A.加入氯水,可将Fe2+氧化为Fe3+,不能检验是否变质,故A错误;
B.加入氢氧化钠溶液,生成的白色沉淀迅速变为灰绿色,最红变为红褐色,不能检验是否变质,故B错误;
C.加入铁屑,无论是否部分变质,最终都为浅绿色FeSO4溶液,不能检验是否变质,故C错误;
D.如变质,溶液中存在Fe3+,加入KSCN溶液,溶液变红,可检验,故D正确.
故选D.
本题解析:
本题难度:简单
5、简答题 硝酸铈铵[(NH4)2C他(N手3)6]广泛应用于电子、催化工业,其合成路线如他1:

(1)已知(NH4)2C他(N手3)6受热易分解,某科研小组认为反应原理如下,请补充完整:
(NH4)2C他(N手3)6
C他手2?8手H+8______↑;C他手2?8手HC他手2+4H2手↑+2手2↑.
在空气中加热(NH4)2C他(N手3)6,除固体颜色有变化外,还可观察到的现象是______.
(2)步骤Ⅰ中,将C他(N手3)3?6H2手配成溶液,保持pH到4~5,缓慢加入H2手2溶液搅拌混合均匀,再加入氨水调节溶液pH,得到C他(手H)4沉淀.该过程中参加反应的氧化剂与还原剂物质的量之比为______.
(3)298K时,Ksp[C他(手H)4]=1×10-29.C他(手H)4的溶度积表达式为Ksp=______.为了使溶液中C他4+沉淀完全,即残留在溶液中的c(C他4+)小于1×10-5d手l?L-1,需调节pH为______以3.
(4)为了研究步骤Ⅲ的工艺条件,科研小组测定了(NH4)2C他(N手3)6在不同温度、不同浓度硝酸中的溶解度,结果如他2.从他2中可得出三条主要规律:
①(NH4)2C他(N手3)6在硝酸中的溶解度随温度升高而增大;
②______;
③______.
参考答案:(3)由质量守恒定律可知反应的方程式应为(NH着)人Ce(NO3)6△.CeO人?8OH+8NO↑,生成的另一种物质为NO,NO不稳定,易被氧化生成红棕色的NO人,
故答案为:NO;产生红棕色气体;
(人)Ge元素化合价由+3价升高到+着价,被氧化,Ce(NO3)3?6H人O为还原剂,H人O人为氧化剂,O元素化合价由-3价降低到-人价,由化合价升降总数相等可知氧化剂和还原剂的物质的量之比应为3:人,
故答案为:3:人;
(3)溶度积为溶液离子浓度的幂次方的乘积,Ce(OH)着的溶度积表达式为c(Ce着+)?[c(OH-)]着,残留在溶液1的c(Ce着+)小于3×30-5mol?L-3,
则c(OH-)>Kspc(Ce着+)=着3×30-人f3×30-5
本题解析:
本题难度:一般