| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《常见的化学电源》典型例题(二)
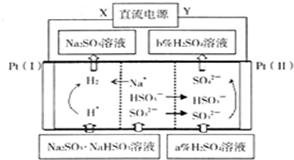 参考答案:A.根据阴阳离子的移动方向知,Pt(I)为阴极,Pt(II)为阳极,所以X为直流电源的负极,Y为直流电源的正极,故A正确; 本题解析: 本题难度:一般 4、填空题 (15分)某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO,从该矿石中提取钴的主要工艺流程如下: 参考答案:(1)12 ; 90 ; (2)3,6,6,1,5,6;(3)1.50; 本题解析:(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如右图所示。由图可知:温度越高,浸出率越高,时间越长,浸出率。但是考虑生产成本和效率,最佳的浸出时间为12小时;最佳的浸出温度为90 ℃;(2)用化合价升降法配平化学方程式为3Fe2(SO4)3+6H2O+6Na2CO3= Na2Fe6(SO4)4(OH)12↓+ 5Na2SO4+ 6CO2↑;(3)KSP(CaF2)= c(Ca2+)×c2(OH-)=1.11×10-10; KSP(MgF2)= c(Mg2+) ×c2(OH-)=7.40×10-11,所以c(Ca2+)/c(Mg2+)= KSP(CaF2)÷KSP(MgF2)= 1.11×10-10÷7.40×10-11=1.50;(4)由于沉淀是从含有SO42-、NH4+、Na+、F-离子的溶液中过滤出来的,所以“沉淀”中含杂质离子主要有SO42-、NH4+、Na+、F-。把沉淀表面的杂质离子洗去、然后干燥就得到固体CoC2O4·2H2O。因此“操作X”名称为洗涤、干燥。(5)因为在充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,所以LiC6中Li的化合价为价;若放电时有1mole-转移,则有1mol的Li变为Li+结合为LiCoO2,所以正极质量增加7g。 本题难度:困难 5、选择题 铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4,工作时的反应为 |
参考答案:D
本题解析:
原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。
A.根据方程式可知,Pb失去电子,在负极被氧化,故A不正确;
B.反应中消耗硫酸,溶液中pH增大,故B不正确;
C.二氧化铅得到电子,是正极,故C不正确;
D.反应中消耗硫酸,溶液中pH增大,故D正确。
考点:化学电源、原电池的工作原理
点评:本题考查了常见的化学电源、原电池的工作原理,难度中等。题目侧重对学生基础知识的巩固与训练,有助于调动学生的学习兴趣和学习积极性。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《盐类水解的.. | |