1、选择题 某溶液中含有大量的Cl-、CO32-、OH-等三种阴离子,如果只取一次该溶液就能够分别将三种阴离子依次检验出来,下列实验操作中,顺序正确的是
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③
B.④②①②③
C.①②③②④
D.④②③②①
参考答案:B
本题解析:先滴加Ba(NO3)2溶液,产生白色沉淀证明含有CO32-,过滤,在滤液中滴加Mg(NO3)2溶液,产生白色沉淀,证明含有OH-,过滤,在滤液中再滴加AgNO3溶液,出现白色沉淀,证明含有Cl-,所以,正确顺序是④②①②③,选B。
本题难度:一般
2、选择题 某溶液既能溶解Al(OH)3,又能溶解Al,但不能溶解Fe,在该溶液中可以大量共存的离子组是( )
A.K+、Na+、HCO
、NO
B.Na+、SO、Cl-、S2-
C.NH、Mg2+、SO、NO
D.H+、K+、Cl-、Na+
参考答案:A.强碱溶液中不能大量存在HCO3-,故A错误;
B.碱溶液中该组离子之间不反应,能大量共存,故B正确;
C.碱溶液中不能大量存在NH4+、Mg2+,故C错误;
D.碱溶液中不能大量存在H+,故D错误;
故选B.
本题解析:
本题难度:简单
3、选择题 对下列实验过程的评价,正确的是(?)
A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
B.某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42-
C.某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性
D.验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl-
参考答案:D
本题解析:加盐酸能产生无色气体的溶液可以是碳酸盐溶液(或碳酸氢盐溶液)也可能是亚硫酸盐溶液(或亚硫酸氢盐溶液),A项错误;滴加BaCl2溶液产生白色沉淀的溶液可能含有SO42-也可能含有SO32-或CO32-,B项错误;某无色溶液滴入紫色石蕊试液显红色,该溶液显酸性,C项错误。答案选D。
点评:进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。
本题难度:简单
4、填空题 (6分)常温下,将0.1000 mol?L-1 NaOH溶液滴入20.00 mL 0.1000 mol?L-1的一元酸HA溶液中,测得混合溶液的pH变化曲线如下图所示。
(1)HA与NaOH溶液反应的离子方程式是?。
(2)图中②点所示溶液中,下列粒子的浓度关系正确的是?(填序号)。
a.2c(Na+)= c(HA)+c(A-)
b.c(Na+)+c(H+)=c(A-)+c(OH-)
c.c(Na+)>c(A-)>c(H+)>c(OH-)
(3)图中③点所示滴入的NaOH溶液的体积V?20.00 mL(填“>”、“<”或“=”)。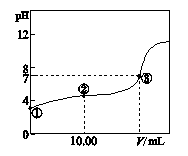
参考答案:(6分)
(1)(2分)HA+OH—=A—+H2O
(2)(2分)ab(漏选得1分,错选不得分)
(3)(2分)<
本题解析:本试题主要考查酸碱中和图像中关于离子浓度大小比较问题,包含中和反应、盐类水解知识的运用。对于此类试题,经常考查的有NaOH~HA弱酸以及氨水~盐酸两类试题。所以,应该记住几个重要的点:起点---可以判断是否是弱电解质或者是起始pH;恰好反应点---酸碱按照化学计量数之比反应,具体的酸碱性取决于盐的水解;恰好中和点----pH=7点;等浓度盐与酸(或碱)点。如果能够将上述的四点分析清楚,此类试题迎刃而解。
(1)据①点可知,此酸为弱酸,所以离子方程式中不进行拆分。
(2)②点为等浓度的HA与NaA混合溶液,此溶液中以HA的电离为主(显酸性),故
c(A-)>c(Na+)>c(H+)>c(OH-),c错误;a为物料守恒,Na原子的各种形式与A原子的各种形式浓度相等,故a正确;b为电荷守恒,正电荷总数=负电荷总数。
(3)图中③点为恰好中和点,如果滴入的NaOH溶液的体积V=20.00 mL时,两者恰好反应,溶液中溶质为NaA,为强碱弱酸盐,显碱性,若要显酸性,则应少加碱,VNaOH<20.00 mL
此试题是一种比较常规的考试题,但是在高考试题中重现率很高,望考生好好分析,并将几种情况一一分析清楚。
本题难度:一般
5、选择题 某无色透明溶液,能与铝反应放出H2,此溶液中可以大量共存的离子组是(?)
A.Na+、NO3-、C1-、OH-
B.H+、Mg2+、NO3-、Ba2+
C.Cu2+、SO42-、C1-、Na+
D.K+、SO42-、Cl-、Na+
参考答案:A
本题解析:略
本题难度:简单