1、推断题 A、B、C、D、E、F为原子序数依次增大的短周期主族元素。已知:A、C、F3种元素的原子最外层共有11个电子,且这3种元素的最高价氧化物对应的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4个;E元素原子的次外层电子数比最外层电子数多3个。
(1)写出下列元素的符号:A________,D________,E________。
(2)B的单质在F的单质中燃烧现象是____________,用电子式表示的反应过程的化学方程式是________________。
(3)A、C两种元素的最高价氧化物对应的水化物反应的离子方程式是____________。
参考答案:(1)Na;Si;P
(2)产生白色的烟;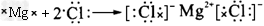
(3)OH-+ Al(OH)3=AlO2-+2H2O
本题解析:
本题难度:一般
2、填空题 根据元素在周期表中的位置,回答下列有关问题:
(1)在1~18号元素中,非金属性最强的元素是______,金属性最强的元素是______.
(2)位于第三周期第VA族的元素的名称为______.
(3)C原子和O原子半径较大的是______.
参考答案:(1)在元素周期表中,非金属性最强的元素在周期表右上角、金属性最强的元素在周期表左下角,稀有气体除外,所以非金属性最强的元素是F、金属性最强的元素是Cs,故答案为:F;Cs;
(2)位于第三周期第VA族的元素的每个电子层上电子数分别为2、8、5,其核外电子数是15,元素原子序数与其原子核外电子数相等,该元素的原子序数是15,为磷元素,故答案为:磷;
(3)同一周期元素中,原子半径随着原子序数的增大而减小,C、O位于同一周期,且C的原子序数小于O,所以原子半径C的较大,故答案为:C.
本题解析:
本题难度:简单
3、填空题 下表标出的是元素周期表的一部分元素,回答下列问题:
(1)表中用字母标出的15种元素中,化学性质最不活泼的是______(用元素符号表示,下同),金属性最强的是______,非金属性最强的是______,常温下单质为液态的非金属元素是______,
(2)B,F,C气态氢化物的化学式分别为______,其中以______最不稳定.
(3)第三周期中原子半径最小的是______.
参考答案:根据元素周期表中元素的分布知识,可以知道:A是F,B是O,C是P,D是C,F是Cl,E是Br,
(1)元素周期表中,从上到下金属的活泼性逐渐增强,从右到左金属活泼性逐渐增强,所以化学性质最活泼的金属在左下角,应该是K,化学性质越活泼则金属性越强,所以金属性最强的也是K,稀有气体元素化学性质是最稳定的,即Ar化学性质是最稳定,元素周期表中,从下到上元素的非金属性逐渐增强,从左到右非金属性逐渐增强,所以非金属性最强的在右上角,应该是F,溴单质在常温下是液体,故答案为:Ar;K;F;Br;
(2)元素周期表中,从下到上元素的非金属性逐渐增强,从左到右非金属性逐渐增强,所以非金属性顺序是Cl>O>P,元素的非金属性越强其对应的氢化物越稳定,则稳定性顺序为:HCl>H2O>PH3,故答案为:H2O、PH3、HCl:;PH3;
(3)同周期元素原子半径从左到右逐渐减小,所以原子半径最小的是Cl,故答案为:Cl.
本题解析:
本题难度:一般
4、推断题 已知五种元素的原子序数的大小顺序为 C> A> B >D >E,A.C同周期,B.C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子的分子。
试回答下列问题:
(1)写出五种元素的元素符号: A_________ B_________ C_________ D_________ E__________。
(2)写出下列物质的电子式:
①D元素形成的单质________________;
②E与B形成的化合物_________________;
③A.B.E形成的化合物___________________;
④D与E形成的化合物_____________________;
⑤D.C.E形成的离子化合物_____________________;
⑥A2B的电子式___________________。
参考答案:(1)Na;O;S;N;H
(2)①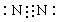 ;②
;②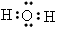 ;③
;③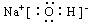 ;④
;④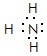 ;⑤
;⑤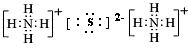
(或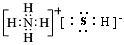 );⑥
);⑥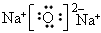
本题解析:
本题难度:一般
5、填空题 原子序数依次增大的四种短周期元素A、B、C、D,其中A与D同主族,B与C同周期,A、D原子的最外层电子数都是1,B原子最外层电子数是次外层电子数的2倍,C原子最外层电子数比B原子多2个。A、C单质在常温下均为气体,它们在点燃下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能激烈反应生成A的单质,所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的两种离子。回答下列问题:
⑴、写出BC2的电子式?______ ,结构式?______ 。
⑵、A、C、D元素形成的化合物中含有的化学键的类型为____? ,该物质的晶体类型是?__ 。
⑶、写出一种由A、B、C、D四种元素共同组成的化合物的化学式?____ 。
参考答案:⑴ , O= C =O?
, O= C =O?
⑵、离子键、共价键;离子晶体
⑶、NaHCO3或Na2CO3·10H2O 或CH3COONa 等。
本题解析:
本题难度:一般