1、选择题 下列实验方案不能达到实验目的的是
[? ]
实验目的
实验方案
A.
证明溴乙烷发生消去反应有乙烯生成
向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液
B.
证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀
向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl3溶液
C.
检验蔗糖水解产物具有还原性
向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入适量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热
D.
测定铝箔中氧化铝的含量
取a g铝箔与足量稀盐酸充分反应,逸出的气体通过碱石灰后,测其体积为b L(已转化为标准状况下)
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列实验操作及结论合理的是( )
A.用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低
B.用盐酸标准溶液滴定待测的氢氧化钠溶液时,酸式滴定管尖嘴处开始有气泡,滴后气泡消失,会使测定结果偏低
C.用湿润pH试纸测溶液pH时,应用滴管取液滴在试纸上,再与标准比色卡对比
D.取a克Na2CO3和NaHCO3混合物于锥形瓶中加适量水溶解,酚酞作指示剂,用cmol?L-1的标准盐酸滴定,可测定混合物中Na2CO3的质量分数
参考答案:D
本题解析:
本题难度:简单
3、选择题 某有机物在氧气中完全燃烧只生成CO2和H2O,实验测知1.6g该有机物在氧气中燃烧后生成的产物依次通过浓硫酸和碱石灰,分别增重3.6g和4.4g,则该有机物的组成是( )
A.只含碳、氢两种元素
B.含碳、氢、氧三种元素
C.肯定含碳、氢元素,可能含有氧元素
D.无法判断
参考答案:A
本题解析:
本题难度:简单
4、实验题 现有不纯氧化铜(所含杂质不与通入的气体反应),下为测定氧化铜纯度的实验。所给出的气体和试剂都是足量的。请根据实验操作过程回答下面的问题:

(1)点燃酒精灯前先要检查________________,原因是______________。
(2)若通入装置I的气体是_____,则选用装置_________,产生的现象是_______________。装置I中发生反应的化学方程式是_______________________。选用装置中发生反应的化学方程式是____________________________。 ?
(3)最后逸出的尾气收入球胆中,原因是_____________________。 ?
(4)请你根据上图,写出两种测定氧化铜纯度的方法,用文字简述其原理和需要测定的数据。①__________________________。?②_________________________。
参考答案:(1)通入气体的纯度;H2或CO与一定量空气混合后遇明火爆炸?
(2)H2或CO;Ⅲ或Ⅱ;试剂2(无水硫酸铜);由白色变成蓝色或试剂1(澄清石灰水)由澄清变浑浊;H2+CuO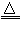 Cu+H2O或CO+Cu
Cu+H2O或CO+Cu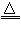 Cu+?CO2、CuSO4+?5H2O=CuSO4
Cu+?CO2、CuSO4+?5H2O=CuSO4 5H2O或
5H2O或
Ca(OH)2+ CO2=CaCO3↓+H2O?
(3)若是氢气,不收集,在一定范围内与空气形成混合气体遇明火爆炸;若是CO,有毒,不收集会污染空气
(4)①方法一:若选用H2还原CuO,可用产生水的质量计算反应的CuO的质量。需要测定:①反应前U形管和内装无水硫酸铜的总质量;② 反应后U形管和内装物的总质量。③反应前后两次的质量差是水的质量。若选用CO还原CuO,可用产生CO2的质量计算反应的CuO的质量。需测定沉淀的质量
②方法二:用H2(或CO)还原CuO后,可用反应前后的直形管和管内物质的总质量的质量差计算反应的CuO的质量。需要测量:①反应前直形管和内装物的总质量;②反应后直形管和内装物的总质量;③反应前后两次的质量差则为减少的氧的质量
本题解析:
本题难度:一般
5、简答题 A、B两种物质都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合,要求A,溶液中的水的电离程度小于A2溶液中水的电离程度;B1溶液中的水的电离程度小于啦溶液中水的电离程度:
(1)请写出下列各物质的化学式:
A1______,A2______,B1______,B2______.
(2)B1溶液中的水的电离程度小于B2溶液中水的电离程度,其原因是:
______.
参考答案:(1)根据给出的元素:H、N、O、Na,其中由三种元素组成的强电解质,中学常见物质有:强碱(NaOH)、强酸(HNO3);盐:NaNO3、NaNO2、NH4NO3、NH4NO2等,A显碱性,只可能是NaOH和NaNO2,B显酸性,可能是HNO3和NH4NO3.强酸、强碱都抑制水的电离,而易水解的盐则促进水的电离.相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度,故A1为NaOH,A2为NaNO2;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度,故B1为HNO3,B2为NH4NO3,
故答案为:NaOH;NaNO2;HNO3;NH4NO3;
(2)硝酸属于酸,对水的电离起抑制作用,硝酸铵属于盐,铵根能水解,对水的电离起到促进作用,所以硝酸溶液中水的电离程度小于硝酸铵溶液中水的电离程度,
故答案为:硝酸电离的氢离子抑制了水的电离,铵根离子存在促进了水的电离;
本题解析:
本题难度:一般