1、选择题 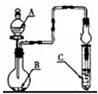 如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是
A.若A为浓硫酸,B为铜,C中盛石蕊试液,则C中溶液先变红后褪色
B.若A为醋酸,B为贝壳,C中盛CaCl2溶液,则C中溶液变浑浊
C.若A为浓硝酸,B为铜,C中盛KI-淀粉溶液,则C中溶液变蓝
D.若A为水,B为CaC2固体,C中盛溴水,则C中溶液褪色
参考答案:CD
本题解析:分析:A、铜与浓硫酸反应需要加热才会生成SO2;
B、醋酸酸性强于碳酸,醋酸和碳酸钙反应生成二氧化碳,通入CaCl2溶液不反应;
C、铜和浓硝酸反应生成二氧化氮气体,二氧化氮气体具有强氧化性,通入KI-淀粉溶液中;可以把碘离子氧化为碘单质;
D、CaC2固体和水剧烈反应生成乙炔气体,通入溴水中,乙炔和溴单质发生加成反应,溴水褪色.
解答:A、铜与浓硫酸反应需要加热才会生成SO2,没有SO2生成,所以C溶液无现象,故A错误;
B、醋酸酸性强于碳酸,醋酸和碳酸钙反应生成二氧化碳,通入CaCl2溶液不反应,C中无现象,故B错误;
C、铜和浓硝酸反应生成二氧化氮气体,二氧化氮气体具有强氧化性,通入KI-淀粉溶液中;可以把碘离子氧化为碘单质;碘单质遇淀粉变蓝,故C正确;
D、CaC2固体和水剧烈反应生成乙炔气体,通入溴水中,乙炔和溴单质发生加成反应,溴水褪色,故D正确;
故选CD.
点评:本题考查了常见气体制备原理的应用和性质验证,主要考查气体制备的反应条件,醋酸酸性强于碳酸,二氧化氮的氧化性,乙炔的加成反应现象,题目难度中等.
本题难度:困难
2、实验题 我国《室内空气质量标准》规定室内空气中甲醛含量不得超过0.08mg·m-3,甲醛(结构简式为HCHO)能与 水任意比互溶但不能在水中电离,能被酸性KMnO4溶液氧化为CO2,而KMnO4则被还原为Mn2+。
(1)请你解释甲醛与水任意比互溶的原因 ____________。
(2)某校研究性学习小组的同学拟对教室内空气中甲醛含量进行测定,如果你参与该研究课题,你采集空气样品的方法是_______________。
(3)该小组同学用已知浓度的KMnO4酸性溶液来测定空气中甲醛的含量。他们认为配制的KMnO4溶液的 浓度宜小不宜大,你觉得他们这样认为的理由是______________ ,请你写出甲醛和KMnO4酸性溶液反应的离子方程式_____________。
参考答案:(1)甲醛分子与水分子之间能形成氢键
(2)用注射器收集空气 (或其他合理答案)
(3)空气中甲醛的含量很小 ;5CH2O+ 4MnO4-+12H+==4Mn2++5CO2+11H2O
本题解析:
本题难度:一般
3、选择题 把碘从碘水里分离出来,有下列基本操作:① 静置后分液 ② 充分振荡 ③ 把碘水倒入分液漏斗,再加入萃取剂四氧化碳。其正确的操作顺序是
[? ]
A.①②③
B.③②①
C.②③①
D.③①②
参考答案:B
本题解析:
本题难度:简单
4、简答题 某种由Al与Al2O3粉末组成的混合物样品,利用如图装置测定混合物中Al的质量分数(已知样品质量为2.58g、锥形瓶和过量NaOH溶液的总质量为185.72g),每隔相同时间读得电子天平的数据如表:
读数次数
质量(g)
|
锥形瓶
+
NaOH溶液
+
试样
第1次
188.30
第2次
188.28
第3次
188.25
第4次
188.24
第5次
188.24
|
(1)Al与NaOH溶液反应的化学方程式为______.
(2)反应中产生的氢气质量为______g
(3)求样品中Al的质量分数.______(要求有计算过程).
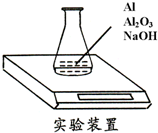
参考答案:(1)铝和氢氧化钠反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)称量至恒重是需要的数据,依据图表数据可知,称重恒重的质量为188.24g,所以反应产生的氢气质量为188.30-188.24=0.06g
(3)依据反应可知,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,生成氢气0.03mol,需要铝物质的量为0.02mol;
样品中Al的质量为0.02mol×27=0.541g;则样品中Al的质量分数为0.54g2.58g×100%=20.9%;
故答案为:生成氢气0.03mol,需要铝物质的量为0.02mol;样品中Al的质量为0.02mol×27=0.541g;则样品中Al的质量分数为0.54g2.58g×100%=20.9%;
本题解析:
本题难度:一般
5、选择题 下列实验方法能够达到实验目的的是
[? ]
A.用BaCl2溶液检验Na2SO3溶液是否变质
B.乙酸乙酯和乙酸钠溶液可以用萃取的方法分离
C.除去酸性FeCl3溶液中少量的FeCl2:加入稍过量的双氧水后放置
D.用溶解、过滤的方法提纯含有少量硫酸钡的碳酸钡
参考答案:C
本题解析:
本题难度:一般