1、选择题 普通玻璃的主要成分是:
①Na2SiO3?②CaCO3?③CaSiO3?④SiO2?⑤Na2CO3?⑥CaO
A.①③⑥
B.②③④
C.①③④
D.③④⑤
参考答案:C
本题解析:普通玻璃是由纯碱、石灰石和石英为原料,主要发生Na2CO3+SiO2 Na2SiO3+CO2和CaCO3+SiO2
Na2SiO3+CO2和CaCO3+SiO2 CaSiO3+CO2制得的,因此主要成分是硅酸钠、硅酸钙和二氧化硅。答案选C。
CaSiO3+CO2制得的,因此主要成分是硅酸钠、硅酸钙和二氧化硅。答案选C。
点评:本题非常基础,难度小。
本题难度:简单
2、选择题 由两种固体组成的混合物,加热分解后残渣固体的质量是原混合物物质的一半,这组混合物可能是(? )
A.Mg(HCO3)2和MgCO3
B.Na2CO3和NaHCO3
C.CaCO3和MgCO3
D.SiO2和NaCl
参考答案:C
本题解析:A项,Mg(HCO3)2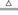 MgO+2CO2↑+H2O与MgCO3
MgO+2CO2↑+H2O与MgCO3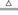 MgO+CO2↑,分解后残留固体的质量都小于原混合物质量的一半;B项,2NaHCO3
MgO+CO2↑,分解后残留固体的质量都小于原混合物质量的一半;B项,2NaHCO3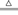 Na2CO3+CO2↑+H2O,分解后残留固体的质量大于原混合物质量的一半;C项,CaCO3
Na2CO3+CO2↑+H2O,分解后残留固体的质量大于原混合物质量的一半;C项,CaCO3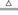 CaO+CO2↑与MgCO3
CaO+CO2↑与MgCO3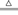 MgO+CO2↑,分解后残留固体的质量一个大于,一个小于原混合物质的一半,有可能符合条件。
MgO+CO2↑,分解后残留固体的质量一个大于,一个小于原混合物质的一半,有可能符合条件。
本题难度:简单
3、填空题 A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于第________族,与A同族但相对原子质量比A小的元素B的原子结构示意图为________,A与B在原子的电子层结构上的相同点是_______________________。
(2)易与C发生化学反应的酸是______ (填名称),反应的化学方程式是_______。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①写出生成D和F的化学方程式:______________________________________,___________________________________________________________________。
②要将NaOH高温熔化,下列坩埚中不可选用的是_________________________。
A.普通玻璃坩埚? B.石英玻璃坩埚
C.氧化铝坩埚? D.铁坩埚
(4)100 g C与石灰石的混合物充分反应后生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是________。
参考答案:(1)ⅣA?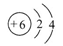 ?最外层均有4个电子,最内层均有2个电子
?最外层均有4个电子,最内层均有2个电子
(2)氢氟酸? SiO2+4HF=SiF4↑+2H2O
(3)①SiO2+Na2CO3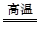 Na2SiO3+CO2↑
Na2SiO3+CO2↑
Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓
②A、B、C
(4)50%
本题解析:(1)A元素单质可作半导体材料,含A元素的某化合物是制造光导纤维的原料,可知A为硅元素,比硅相对原子质量小的同族元素为碳。
(2)C为SiO2,能与SiO2反应的酸只有氢氟酸。
(3)SiO2与NaOH反应生成Na2SiO3和H2O,故含SiO2的材料(普通玻璃、石英玻璃)以及Al2O3等都能与NaOH在高温下反应,故不能用以上材质的坩埚熔化NaOH。
(4)根据反应SiO2+CaCO3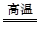 CaSiO3+CO2↑,
CaSiO3+CO2↑,
CaCO3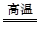 CaO+CO2↑可知,无论SiO2和CaCO3是否恰好完全反应,均有关系式CaCO3~CO2存在,故n(CaCO3)=n(CO2)="0.5" mol,m(CaCO3)="50" g。
CaO+CO2↑可知,无论SiO2和CaCO3是否恰好完全反应,均有关系式CaCO3~CO2存在,故n(CaCO3)=n(CO2)="0.5" mol,m(CaCO3)="50" g。
本题难度:一般
4、填空题 “蛇纹石石棉”主要成分有二氧化硅、氧化镁和结晶水,它的化学式是Mg6[(OH)4Si2O5]2。
(1)“蛇纹石石棉”的氧化物形式为______________________,其中原子半径最大的元素
在周期表中的位置是______________________。
(2)Si原子的最外层的电子排布式为_____________,SiO2与NaOH溶液反应的化学方程式
为________________________________________________。
(3) SiCl4比SiO2的熔点_____(填“低”、“高”),原因是__________________________。
(4)从哪些方面不能判断Si和O的非金属性强弱?。
A.利用Si和O在周期表中的位置
B.SiO2与水不发生反应
C.Si在一定条件下与氧气反应,生成SiO2
D.H2SiO3的酸性比H2O的酸性强
参考答案:(1)6MgO·4SiO2·4H2O? (1分)?第三周期ⅡA? (1分)
(2)3s23p2(1分)? SiO2+2NaOH→Na2SiO3+H2O? (1分)
(3)低? (1分)? SiCl4是分子晶体,晶体中主要作用力是较弱的分子间作用力;SiO2是原子晶体,晶体中的作用力为共价键,所以后者的熔点更高(1分)
(4)BD? (2分)
本题解析:(1)“蛇纹石石棉”的氧化物形式在进行变换写法时,将各元素表示成氧化物的形式,注意原子个数和元素种类不能变,化合价不能改变,故答案为:6MgO·4SiO2·4H2O。其中原子半径最大的元素是镁,在周期表中的位置是第三周期ⅡA 。
(2)Si原子的最外层的电子排布式为3s23p2,SiO2是酸性氧化物,与NaOH溶液反应生成盐和水,化学方程式为 SiO2+2NaOH→Na2SiO3+H2O 。
(3)SiCl4是分子晶体而SiO2是原子晶体,故后都的熔点高。
(4)从哪些方面不能判断Si和O的非金属性强弱A.利用Si和O在周期表中的位置处于同一周期左到右元素非金属性增强,可以判断。B.SiO2与水不发生反应这不能做为判断依据;C.Si在一定条件下与氧气反应,生成SiO2,由于氧的非金属性强,故化合价为负;可以判断。D.H2SiO3的酸性比H2O的酸性强,无法判断。故选BD。
本题难度:一般
5、选择题 下列关于硅的说法不正确的是
A.硅是非金属元素,但它的单质是灰黑色有金属光泽的固体
B.硅的导电性能介于金属和绝缘体之间,是良好的半导体材料
C.在常温下,硅的化学性质活泼
D.硅是人类将太阳能转换为电能的常用材料
参考答案:C
本题解析:A.正确,硅是非金属元素,在同期表中位于金属和非金属之间,所以它的单质是灰黑色有金属光泽的固体
B.正确,硅的导电性能介于金属和绝缘体之间,是良好的半导体材料。
C.不正确,在常温下,硅的化学性质不活泼,化学性质非常稳定。在常温下,除氟化氢以外,很难与其他物质发生反应。
D.正确,硅是人类将太阳能转换为电能的常用材料,应用于制造太阳能电池。
选C。
本题难度:一般