1、填空题 下图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为 mol·L-1。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是 。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400 mol/L的稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
②配制溶液除烧杯和玻璃棒,还需要的仪器是 、 、 。
③实验开始时,需要检查 。
④配制时,下列操作正确的顺序是(用字母表示) 。
A.洗涤 B.定容 C.溶解 D.摇匀 E.冷却 F.称量 G.转移
⑤在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填“偏大”、“偏小”或“无影响”)。
Ⅰ.用量筒量取浓盐酸时俯视观察凹液面( )
Ⅱ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水( )
Ⅲ.配制时,容量瓶有少量蒸馏水( )]
Ⅳ.定容时仰视刻度线( )
参考答案: (1) 11.9mol/L (2) BD (3)①16.8mL ②量筒、500mL容量瓶、胶头滴管
③容量瓶是否漏水 ④FCEGABD ⑤偏小 偏小 无影响 偏小
本题解析:(1) 直接根据公式计算: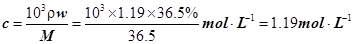 。(2) A、溶液中HCl的物质的量=nV,所以与溶液的体积有关,A不合题意;B、溶液的浓度
。(2) A、溶液中HCl的物质的量=nV,所以与溶液的体积有关,A不合题意;B、溶液的浓度 ,与溶液的体积无关,B符合题意;C、溶液中Cl
,与溶液的体积无关,B符合题意;C、溶液中Cl
本题难度:一般
2、简答题 右图为实验室某盐酸试剂瓶的标签上的有关数据,试回答下列问题:
(1)计算该盐酸中HCl的物质的量浓度;
(2)实验室需要1.19mol/L盐酸20mL,计算所需上述盐酸的体积.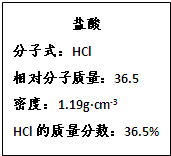
参考答案:(1)该盐酸的物质的量浓度=1000×1.19×36.5%36.5mol/L=11.9mol/L,
答:该盐酸的物质的量浓度为11.9mol/L.
(2)令需要浓盐酸的体积为VmL,根据稀释定律,稀释前后HCl的物质的量不变,则:
11.9mol/L×VmL=20mL×1.19mol/L,
解得V=2,
答:需要该盐酸的体积为2mL.
本题解析:
本题难度:一般
3、填空题 (10分)根据所学知识填空:
(1)3.01×1023个OH-中含有质子的物质的量为?mol,含电子的数目为?,与?molNH3具有相同的质量。
(2)同温同压下,气体A与氧气的质量比为1∶2,体积比为1∶4,气体A的摩尔质量是?
(3)在标准状况下,如果2.8L氧气含有n个氧原子,则阿伏加德罗常数可表示为?
参考答案:(1)4.5mol? 3.01×1024? 0.5mol
(2)64g/mol
(3)4n(每空2分)
本题解析:略
本题难度:简单
4、实验题 用氯化钠固体配制1.00mol/L的NaCl溶液95mL,回答下列问题
⑴所需仪器为:托盘天平、量筒、烧杯胶头滴管,若要完成实验,还需要两种玻璃仪器为 、 。
⑵该实验的实验步骤为:
①计算,②称量 gNaCl, ③溶解,④移液,⑤洗涤,⑥定容,⑦ 摇匀。
⑶试分析下列操作,对所配溶液的浓度有何影响。(用偏低、偏高、无影响填空)。
①用天平称量氯化钠后,发现砝码底部有锈斑。所配溶液的浓度 ;
②为加速固体溶解,微热烧杯溶液并不断搅拌。在未降至20℃时,就将溶液转移至容量瓶定容。所配溶液的浓度 ;
③容量瓶不干燥,含有少量蒸馏水。所配溶液的浓度 ;
④若定容时仰视刻度线。所配溶液的浓度 ;
⑤定容后,加盖、倒转、摇匀后,发现液面低于刻度线,又补加蒸馏水至刻度。则所配溶液的浓度 。
参考答案:⑴100 mL容量瓶 玻璃棒 ⑵5.9 ⑶①偏高 偏高 无影响 偏低 偏低
本题解析:(1)由于实验室没有95ml容量瓶,所以要用氯化钠固体配制1.00mol/L的NaCl溶液95mL,则需要100ml容量瓶,另外还缺少溶解和转移时的玻璃棒。
(2)需要氯化钠的质量=0.1L×1.00mol/L×58.5g/mol=5.85g≈5.9g。
(3)根据cB=nB/V可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大。①用天平称量氯化钠后,发现砝码底部有锈斑,这说明砝码质量偏大,因此氯化钠的质量偏大,则所配溶液的浓度偏高;②为加速固体溶解,微热烧杯溶液并不断搅拌。在未降至20℃时,就将溶液转移至容量瓶定容,则冷却后容量瓶中溶液的体积偏少,因此所配溶液的浓度偏高;③容量瓶不干燥,含有少量蒸馏水,对所配溶液的浓度不影响;④若定容时仰视刻度线,则容量瓶中溶液的体积偏大,因此所配溶液的浓度偏低;⑤定容后,加盖、倒转、摇匀后,发现液面低于刻度线,又补加蒸馏水至刻度,则容量瓶中溶液的体积偏大,因此所配溶液的浓度偏低。
考点:考查移动物质的量浓度配制以及误差分析
本题难度:一般
5、实验题 为了测定某种烷烃(不溶于水,密度比空气大)样品的平均相对分子质量,设计了下面的实验:
①取一个配有合适胶塞的洁净、干燥的锥形瓶,准确称其质量为m1;
②往锥形瓶中通入干燥的该烃的样品,塞好胶塞,准确称量,重复操作,直到前后两次称量结果基本相同,得到质量为m2;
③往锥形瓶中加满水,塞好胶塞,准确称量,得到质量为m3。已知:空气的平均相对分子质量为29.0,完成下列问题:

可供选用的装置
(1)具体说明本实验的原理________________________________________________。
(2)步骤②为什么要重复操作直到前后两次称量的结果基本相同?___________________。
(3)具体说明本实验中如何做到每次测量都在相同体积下进行________________________。
(4)本实验中收集气体样品的操作,可选用的方法是(用图中的标号填写)_____________。
(5)写出锥形瓶中样品的质量m样品的计算式____________________(设空气的质量为m空气)
(6)写出由实验测得该烷烃的平均相对分子质量为____________________(计算式)。
参考答案:(1)根据阿伏加德罗定律——同温、同压下,同体积的两种不同气体的质量之比等于相对分子质量之比
(2)保证瓶内空气完全排尽,样品恒重
(3)在第一次称量前,待锥形瓶塞紧胶塞后,在瓶口胶塞上做一标记,以后每次测量,胶塞塞入瓶口的位置都以此为准
(4)D
(5)m2-m1+m空气
(6)29.0×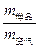 或29.0×
或29.0×
本题解析:测定烷烃样品的平均相对分子质量用的是阿伏加德罗定律的推论,即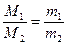 ;在测量过程中采用了测平均数据法(重复操作、两次测量结果基本相同)可保证实验时瓶内空气完全排尽,使结果准确;为使每次测量都在相同的体积下进行,便须对锥形瓶中所容纳物质的体积进行标记;由于空气的平均相对分子质量为29.0,而样品的平均相对分子质量大于29.0,故要采用向上排空气法收集(注意不能用排水法,否则将在样品中混入水蒸气而影响测定结果);由实验操作可知,m1为锥形瓶与空气的总质量,m2为锥形瓶与烷烃样品的总质量,则m样品=m2-m1+m空气。
;在测量过程中采用了测平均数据法(重复操作、两次测量结果基本相同)可保证实验时瓶内空气完全排尽,使结果准确;为使每次测量都在相同的体积下进行,便须对锥形瓶中所容纳物质的体积进行标记;由于空气的平均相对分子质量为29.0,而样品的平均相对分子质量大于29.0,故要采用向上排空气法收集(注意不能用排水法,否则将在样品中混入水蒸气而影响测定结果);由实验操作可知,m1为锥形瓶与空气的总质量,m2为锥形瓶与烷烃样品的总质量,则m样品=m2-m1+m空气。
本题难度:简单