| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《化学反应与能量》练习题(六)
参考答案:A 本题解析:根据题意可知,石墨的能量小于金刚石的,能量越低越稳定,所以石墨稳定。金刚石和石墨都是碳的同素异形体,二者的结构不同,它们之间相互转化是化学变化,答案选A。 本题难度:一般 3、选择题 已知H+(aq) + OH-(aq) = H2O (l) ;△H =" -57.3" KJ/mol . 则下列热化学方程式正确的是 |
参考答案:D
本题解析:A.由于醋酸是弱酸,电离需要吸收热量,所以A.CH3COOH(aq) + NaOH(aq) = CH3COONa (aq) + H2O(l); △H>-57.3KJ/mol,错误;B.在反应产生BaSO4时形成化学键要释放能量,因此反应热要比-57.3 KJ/mol小,错误;D.离子方程式与题干吻合,反应热相同,正确。
考点:考查关于中和热的方程式的书写的知识。
本题难度:一般
4、选择题 下列叙述中正确的是( )
A.元素电负性越大,元素第一电离能越大
B.键能越大,键长越长,共价化合物越稳定
C.副族元素中没有非金属元素
D.离子化合物的熔点一定比共价化合物的高
参考答案:C
本题解析:A、元素电负性越大,元素第一电离能越小,故错;B、键长越长,键能必越小,共价化合物应该是越不稳定,故错;D、共价化合物可分分子晶体和原子晶体,其中分子晶体熔点比离子晶体低,而原子晶体一般都比较高,故错。故选C。
点评:本题考查的是知识比较综合,题目难度不大,考查学生对基础知识的学习、掌握及应用。
本题难度:简单
5、选择题 已知断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol H—N键吸收的能量为391 kJ,根据化学方程式:N2(g)+3H2(g)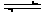 2NH3(g) ΔH=-92.4 kJ·mol-1,则断裂1 mol N≡N键吸收的能量是
2NH3(g) ΔH=-92.4 kJ·mol-1,则断裂1 mol N≡N键吸收的能量是
A.431 kJ
B.945.6 kJ
C.649 kJ
D.869 kJ
参考答案:B
本题解析:
试题解析:已知:H-H键能为436kJ/mol,H-N键能为391kJ/mol,设N≡N的键能为x,对于反应N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,反应热=反应物的总键能-生成物的总键能,
故x+3×436kJ/mol-2×3×391kJ/mol=-92.4kJ/mol,解得:x="945.6" kJ/mol故选B.
考点:有关反应热的计算
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《微量元素》.. | |