1、选择题 下列说法不正确的是
[? ]
A.共价化合物和离子化合物中,一定都含有非金属元素
B.一个化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程
C.全部由非金属构成的化合物一定不存在离子键
D.共价化合物都是由分子构成的,而离子化合物中一般不存在单个分子
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列说法中错误的是
A.干冰与二氧化硅晶体熔化时,所克服的微粒间相互作用不相同
B.C2H5OH与C2H5Br相比,前者的相对分子质量远小于后者,而沸点却远高于后者,其原因是前者的分子间存在氢键
C.非金属单质只能形成分子晶体
D.短周期元素离子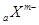 和
和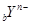 具有相同的电子层结构,若
具有相同的电子层结构,若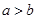 ,则
,则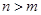
参考答案:C
本题解析:A正确,干冰为分子晶体,熔化时要克服分子间的作用力,而二氧化硅为原子晶体,熔化时要克服共价键;B正确,C2H5OH分子间存在氢键,而C2H5Br不存在氢键,氢键的存在能影响物质的熔沸点;C错,如金刚石、晶体硅都是非金属单质,但属于原子晶体;D正确,具有相同电子层结构的离子,核外电子总数相同,即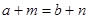 ,若
,若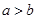 ,则
,则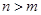
本题难度:一般
3、推断题 A,B,C,D是同一周期的4种元素,A,B,C,D的原子序数依次相差为1。A元素单质的化学性质活泼,A元素的原子在此周期中原子半径最大。B元素的氧化物2.0g恰好跟100 mL 0. 50 mol/L的硫酸完全反应,B元素单质跟D元素单质反应生成化合物BD2。根据以上事实填写下列空白:
(1)A的原子结构示意图为______,C的原子结构示意图为_______,BD2的电子式为_______;
(2)若向C的氧化物的水化物中加入A的氧化物的水化物,则溶液显碱性。此反应的化学方程式为
_______。
参考答案:(1)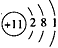 ;
;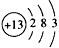 ;
;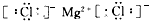
(2)Al(OH)3+NaOH==NaAlO2+2H2O
本题解析:
本题难度:一般
4、选择题 美国科学家通过“勇气”号太空车探测出水星大气中含有一种称为硫化羰(化学式为COS)的物质,已知硫化羰与二氧化碳的结构相似,但能在氧气中完全燃烧,下列有关硫化羰的说法正确的是
A.1 mol硫化羰在氧气中完全燃烧时转移6mol电子
B.硫化羰可用作灭火剂
C.CO2和COS结构相似都是非极性分子
D.硫化羰熔点可能较高
参考答案:A
本题解析:硫化羰由三种元素组成,其中C、O、S的化合价分别是+4价、-2价和-2价。燃烧后生成CO2和SO2,其中S元素的化合价从-2价升高到+4价,失去6个电子,A正确;据题中描述硫化羰“能在氧气中完全燃烧”可知,硫化羰具有可燃性,所以不能用作灭火剂,B不正确;硫化羰与二氧化碳的结构虽然相似,但该化合物是极性分子,C不正确;硫化羰形成的晶体应该是分子晶体,其熔点不可能很高,D不正确,答案选A。
点评:该题以新科技、新发现为载体,有利于调动学生的学习兴趣,激发学生的学习积极性,有利于培养学生灵活运用基础知识解决实际问题的能力,难度不大。
本题难度:一般
5、填空题 已知A、B、C、D均是元素周期表中前36号中的元素,其原于序数依次递增,其他相关结构或性质信息如下表。
元素
| 结构或性质信息
|
A
| 原子核外有一个未成对电子,其氢化物与水分子间能形成氢键
|
B
| 原子核外M层电子数是N层电子数的4倍
|
C
| 是使用最为广泛的合金的主要成分
|
D
| 原子各内层电子均已饱和,最外层电子数为1
|
?
请根据信息回答有关问题:
(1)C元素在周期表中的位置为____?,D元素原子的外围电子排布式为?
(2)用氢键表示式写出A的氢化物水溶液中存在的所有氢键____?。
(3)A与氧可形成原子个数比为2:1的三原子分子,其中氧的化合价为____?,氧原子杂化类型与下列分子的中心原子杂化类型相同的是____?
a:CO2?b:SO2? c:NH3?d;CH4
(4)A、B可形成离子化合物,其晶胞结构如下图甲所示,则晶胞中B离子的个数为____?,与B离子最近且等距的A离子的个数为?。
(5)1183 K以下C晶体的晶胞如图乙中图1,而1183 K以上则转变为图2,在两种晶胞中最邻近的C原子间距离相同,则图1、图2所示两种晶中原子的空间利用率之比为___? _(可用根号表示)。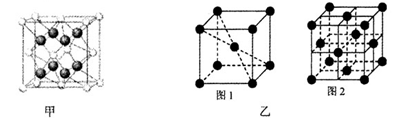
参考答案:(1)第四周期Ⅷ族(1分)? 3d104s1(2分)
(2)F—H…F、F—H…O、O—H…F、O—H…O(4分或其他正确表示)
(3)+2(1分)cd(2分)
(4)4(1分)? 8(1分)
(5)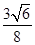 或0.92:1或68%:74%等合理答案均给分(3分)
或0.92:1或68%:74%等合理答案均给分(3分)
本题解析:原子核外有一个未成对电子,其氢化物与水分子间能形成氢键,因此A是F元素;原子核外M层电子数是N层电子数的4倍,这说明M是20号元素Ca;C是使用最为广泛的合金的主要成分,因此C是铁元素;原子各内层电子均已饱和,最外层电子数为1,则D是29号元素Cu。
(1)铁元素在周期表中的位置为第四周期Ⅷ族;铜元素原子的外围电子排布式为3d104s1。
(2)F和O都是活泼的非金属,能形成氢键,所以A的氢化物水溶液中存在的所有氢键为F—H…F、F—H…O、O—H…F、O—H…O。
(3)F的非金属性强于氧元素,在化合物中F只有-1价,所以如果A与氧可形成原子个数比为2:1的三原子分子,则其中氧的化合价为+2价。在该分子中氧元素含有的孤对电子对数=(6-2×1)÷2=2,因此 该分子是V形结构,氧元素是sp3杂化。CO2、SO2、NH3、CH4分子中中心原子的杂化轨道类型分别是sp、sp2、sp3、sp3,所以答案选cd。
(4)A、B形成离子化合物是CaF2,则根据晶胞结构可知,晶胞中B离子的个数为=8× +6×
+6×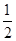 =4个;与B离子最近且等距的A离子的个数为8个。
=4个;与B离子最近且等距的A离子的个数为8个。
(5)设铁原子半径是r,立方体边长图1是a,图2是b,则根据图1可知a2+2a2=(4r)2,解得a=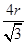 ,所以图1中铁原子的空间利用率是
,所以图1中铁原子的空间利用率是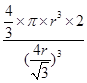 。根据图2可知b2+b2=(4r)2,解得b=
。根据图2可知b2+b2=(4r)2,解得b=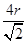 ,所以图2中铁原子的空间利用率是
,所以图2中铁原子的空间利用率是 ,所以铁原子的空间利用率之比为
,所以铁原子的空间利用率之比为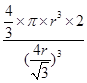 :
: =
=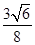 。
。
本题难度:一般