1、填空题 在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:2MnO4-+5C2O42-+16H+
2Mn2++10CO2↑+8H2O
(1)若用托盘天平称取WgNa2C2O4晶体,称量时需移动游码,应用______(填工具名称)拨动游码.
(2)若将WgNa2C2O4配成100mL标准溶液,移取20.00mL置于锥形瓶中,则酸性KMnO4溶液应装在______(填“酸式”或“碱式”)滴定管中,需要润洗的是______(填“滴定管”或“锥形瓶”).判断滴定达到终点的现象是______.
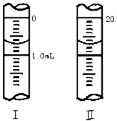
(3)若滴定管的起始读数和终点读数如图,则酸性KMnO4溶液消耗的体积为______mL,KMnO4溶液的物质的量浓度为______mol/L(填表达式).
2、简答题 化学探究小组用H2C2O4(草酸)溶液测定KMnO4溶液的浓度.请回答下列问题:
I、取20.00mL0.250mol/L?H2C2O4标准溶液置于锥形瓶中,加入适量稀硫酸酸化,用KMnO4溶液进行滴定.滴定反应方程式为(未配平):
KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O
记录数据如下:
| 滴定次数 | 标准溶液体积/mL | 待测溶液体积/mL
滴定前刻度
滴定后刻度
1
20.00
1.50
23.70
2
20.00
1.02
21.03
3
20.00
2.00
21.99
|
(1)滴定时,KMnO4溶液应装在______滴定管中(选填:酸式、碱式).
(2)滴定终点的判断方法是:______.
(3)根据上述数据计算,该KMnO4溶液的浓度为______mol/L.
(4)下列操作中使得KMnO4溶液浓度偏低的是______.
A.滴定管用水洗净后直接注入KMnO4溶液
B.滴定前盛放标准H2C2O4溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定管内在滴定前有气泡,滴定后气泡消失
D.读取KMnO4溶液体积时,滴定前平视,滴定结束后俯视读数
II、滴定中发现,KMnO4紫红色褪去的速度开始时很慢、后来变快、最后又变慢.为研究由慢到快的原因,甲同学继续进行了下列实验,实验数据如下表:
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s
1
25
5.0
2.0
40
2
25
5.0(另外加少量MnSO4粉末)
2.0
4
3
60
5.0
2.0
25
|
(5)分析上述数据,对确定过程中反应速率由慢到快的合理解释是______.
3、选择题 在化学实验操作中,往往由于读数不规范导致较大的实验误差。下列有关实验中,会导致所配制(或所测定)溶液浓度偏大的是(其他操作均正确)
[? ]
A.配制500mL 1mol/L稀硫酸实验中,用量筒量取18.1mol /L浓硫酸时俯视读数
B.配制1mL 5.1mol/L氯化钠溶液实验中,定容时仰视
C.用标准盐酸滴定特测NaOH溶液实验中,使用碱式滴定管开始平视,后来俯视读数
D.用标准NaOH溶液滴定特测盐酸实验中,使用碱式滴定管开始平视,后来俯视读数
4、选择题 用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考右图,从下表中选出正确选项( )
| 锥形瓶中液体 | 滴定试管中液体 | 选用指示剂 | 选用滴定管
①
碱
酸
石蕊
(乙)
②
酸
碱
酚酞
(甲)
③
碱
酸
甲基橙
(甲)
④
酸
碱
酚酞
(乙)
|
A.①
B.②
C.③
D.④