1、选择题 在硫酸的工业制法中,下列生产操作及对采取此操作的主要原因的叙述都正确的是()
A.硫铁矿燃烧前需要粉碎,因为大块的不能在空气燃烧
B.沸腾炉出来的炉气需净化,因为其中的SO2会与杂质反应
C.SO2氧化为SO3时,使用催化剂可以提高硫酸的产率
D.SO3用98.3%的浓硫酸吸收,目的是防止形成酸雾,以使SO3吸收完全
2、填空题 减少SO2的排放、回收利用SO2成为世界性的研究课题。我国研究人员研制的利用低品位软锰矿浆(主要成分是MnO2)吸收废渣高温焙烧产生的SO2,制备硫酸锰的生产流程如下:
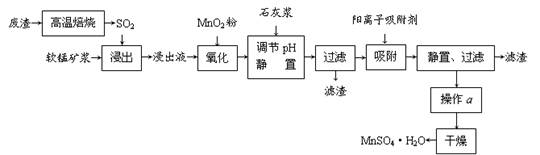
浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。
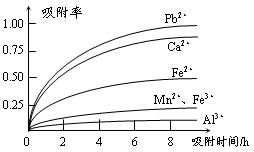
有关金属离子的半径以及形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
离子
| 离子半径(pm)
| 开始沉淀时的pH
| 完全沉淀时的pH
|
Fe2+
| 74
| 7.6
| 9.7
|
Fe3+
| 64
| 2.7
| 3.7
|
Al3+
| 50
| 3.8
| 4.7
|
Mn2+
| 80
| 8.3
| 9.8
|
Pb2+
| 121
| 8.0
| 8.8
|
Ca2+
| 99
| -
| -
|
?
已知PbO2的氧化性大于MnO2。请回答下列问题:
⑴ 写出浸出过程中主要反应的化学方程式?,氧化过程中主要反应的离子方程式?。
⑵ 在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至?。
⑶ 阳离子吸附剂用于除去杂质金属离子。决定阳离子吸附剂吸附效果的因素是?(填写序号)。
a.溶液的pH?b.金属离子的电荷?c.金属离子的半径?d.吸附时间
⑷ 操作a包括?等过程。
3、选择题 在接触法产生H2SO4的过程中,对“废气、废水、废渣、废热”的处理正确的是( )
①废气用氨水处理 ②污水用石灰乳处理 ③废渣用来造水泥或炼铁 ④设置“废热”锅炉产生蒸气来供热或发电
A.只有①②
B.只有①③④
C.只有①②③
D.全部
4、选择题 “原子经济”这一术语是由斯坦福大学Barry Trost教授提出来的,这是一个关于有多少反应物转变成最终产物的概念。最理想的经济当然是全部反应物的原子嵌入期望的最终产物中,不产生任何废弃物,这时的原子经济便是100%。下列反应中原子经济百分数有可能达到100%的反应是(?)
A.取代反应
B.加成反应
C.酯化反应
D.水解反应
5、选择题 化学?与环境保护密切相关,下列叙述正确的是
[? ]
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.处理废水时加入明矾作为消毒剂可以除去水中的杂质
C.PM2.5(2.5微米以下的细颗粒物)主要来自化石燃料的燃烧
D.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2