| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《离子方程式的书写及正误判断》试题预测(2019年最新版)(十)
参考答案:B 本题解析: 漏掉了某些反应,硫酸钡的产生: 本题难度:一般 2、选择题 下列离子方程式中正确的是 |
参考答案:C
本题解析:A项应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,错误;B项应为2H2O+2Al+2OH-=2AlO2-+3H2↑,错误;D项醋酸为弱酸所以不能用H+表示,错误。
考点:离子方程式的书写。
本题难度:一般
3、填空题 (10分)无机化合物可根据其组成和性质进行分类:
(1)下图所示的物质分类方法名称是 ;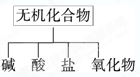
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥的后面;(只需填一种)
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | ①HCl ② | ③ ④Ba(OH)2 | ⑤Na2CO3 ⑥ | ⑦CO2 ⑧Na2O2 |
参考答案:(10分)(1)树状分类法 (2分) (2)②H2SO4 ③ NaOH ⑥ K2CO3 (合理即可) (6分)(3)2OH-+CO2=CO32-+H2O (2分)
本题解析:(1)物质分类常用树状分类法和交叉分类法,此分类法为树状分类法。(2)电离出阳离子全部是氢离子的化合物是酸,电离出阴离子全部是氢氧根离子的化合物是碱,由金属阳离子和酸根阴离子形成的化合物是盐,由两种元素形成的化合物,其中一种是氧元素的化合物是氧化物;(3)二氧化碳与氢氧化钠反应生成碳酸钠,离子方程式为2OH-+CO2=CO32-+H2O 。
考点:物质的分类
本题难度:一般
4、选择题 下表中评价合理的是
| 选项 | 化学反应及其离子方程式 | 评价 |
| A. | NaHSO4溶液与Ba(OH)2溶液反应至中性: 2H++SO42 |
参考答案:
本题解析:
本题难度:一般
5、填空题 把CO2通入浓的NaOH溶液中,反应开始时反应的离子方程式为 ;若继续通入CO2直至过量,则有细小晶体析出,其反应的化学方程式为 ;
然后将析出晶体后的溶液分成2等份,分别滴入少量下列溶液,反应的离子方程式为:
⑴NaOH溶液: ;
⑵HCl溶液: 。
参考答案:CO2+2NaOH=Na2CO3+H2O CO2+NaOH= NaHCO3或 Na2CO3+H2O + CO2 = 2NaHCO3
HCO3-+ OH- = CO32- + H2 O
HCO3-+ H+= CO2+H2 O
本题解析:略
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《阿伏伽德罗.. | |