1、填空题 (1)现有废铜屑和废硫酸,请从原料的利用率和环保的角度分析,设计一个制取胆矾(CuSO4?5H2O)的合理方案,只用化学方程式说明
第一步:______
第二步:______
第三步:过滤,加热浓缩,冷却结晶______
(2)有人建议用铜和稀硫酸混合在加热的条件下不断通入空气以制得硫酸铜溶液,请写出该反应的化学方程式______.
参考答案:(1)以废铜屑和废硫酸为原料,从原料的利用率和环保的角度分析,设计制取胆矾(CuSO4?5H2O)的方案应:铜与氧气反应生成氧化铜,再由氧化铜与硫酸反应生成硫酸铜,最后过滤,加热浓缩,冷却结晶可得CuSO4?5H2O.
故反应方程式为第一步:2Cu+O2?△?.?2CuO;
第二步:CuO+H2SO4=CuSO4+H2O;
第三步:CuSO4+5H2O=CuSO4?5H2O.
故答案为:2Cu+O2=2CuO;CuO+H2SO4=CuSO4+H2O;CuSO4+5H2O=CuSO4?5H2O.
(2)铜和稀硫酸混合在加热的条件下不断通入空气,反应生成硫酸铜与水,方程式为2Cu+O2+2H2SO4?△?.?2CuSO4+2H2O.
故答案为:2Cu+O2+2H2SO4?△?.?2CuSO4+2H2O.
本题解析:
本题难度:一般
2、选择题 下列除杂质选用的试剂和主要操作都正确的是( )
| 物质 | 杂质 | 试剂 | 主要操作
A
SiO2
CaCO3
盐酸
过滤
B
NaHCO3
Na2CO3
盐酸
加热
C
Fe
Al
氢氧化钠
分液
D
Fe(NO3)2
Ba(NO3)2
硫酸
过滤
|
A.A
B.B
C.C
D.D
参考答案:A.碳酸钙溶于盐酸,而二氧化硅不反应,可加入盐酸,然后用过滤的方法分离,故A正确;
B.NaHCO3和Na2CO3都与盐酸反应,不能加入盐酸除杂,如是溶液的话,可通入过量二氧化碳除杂,故B错误;
C.铁不溶于氢氧化钠溶液,应用过滤的方法分离,故C错误;
D.加入硫酸,亚铁离子被氧化生成铁离子,应加入硫酸亚铁溶液,然后过滤,故D错误.
故选A.
本题解析:
本题难度:简单
3、选择题 在烧杯甲中放入20g X,在烧杯乙中放入20gY与M的混合物,分别加入20mL水,搅拌,使它们溶解,把盛有少量乙醚液体的试管浸入烧杯乙的溶液中,用明火接近试管口,发现没有现象;再把此试管浸入烧杯甲的溶液中,用明火接近试管口,管口能产生黄色火焰
上述两实验可说明的是(?)
①乙醚可燃?②乙醚的沸点较低? ③Y和M混合可能吸收大量热? ④X溶于水能放出大量的热
A.①②③
B.①③④
C.②③④
D.①②③④
参考答案:
D
本题解析:
依题意,“明火靠近试管口,能产生黄色火焰”,说明,乙醚蒸气能燃烧,且在甲烧杯中乙醚液体变成蒸气,推知,乙醚沸点低;黄色火焰熄灭,说明乙醚由蒸气变成液体。由此推知,D正确。
本题难度:一般
4、实验题 铁在冷的浓硫酸中能发生钝化现象。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。
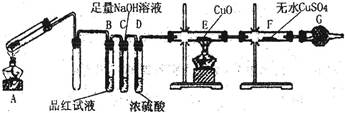
(1)证明反应所产生的气体中有SO2生成的现象是?。
(2)证明气体中含有氢气的实验现象是?。
(3)为了进一步探究反应后A溶液中铁元素的价态,他们进行了如下的假设:
假设1:溶液中铁元素既有Fe3+也有Fe2+
假设2:溶液中铁元素只有Fe3+
假设3:溶液中铁元素只有________________
基于假设1,现有试剂:0.01 mol/L酸性KMnO4溶液、稀溴水溶液、0.1 mal/L KI溶液、
淀粉溶液、KSCN溶液,蒸馏水。请探究其所得溶液。请完成表中内容。
【实验探究】
实验操作
| 预期现象
| 结论
|
取反应后的A溶液分装在a、b两试管,步骤①:往a试管中滴入?
?。
| ?
?
| ?
?
|
步骤②:往b试管中滴入?
?。
| ?
?
| 溶液含有Fe3+
|
?
参考答案:(16分)(1)品红试液变浅(或褪色)?(2分)
(2)E中黑色(CuO)变成红色,F中白色粉末(CuSO4)变成蓝色;(2分)
(3)假设3:溶液中铁元素只有Fe2+?(2分)
【实验探究】
实验操作
预期现象
结论
取反应后的A溶液分装在a、b两试管,步骤①:往a试管中滴入少量(1分)0.01mol/L酸性KMnO4溶液(1分)。
KMnO4溶液的紫红色褪去(或变浅)(2分)
?溶液含有Fe2+(2分)
步骤②:往b试管中滴入几滴(1分)KSCN溶液,充分振荡(1分)[或几滴(或少量)0.1mol/LKI溶液和淀粉溶液(1分)] 。
溶液变为血红色(2分)
[或溶液变为蓝色(2分)]
溶液含有Fe3+
本题解析:(1)SO2具有漂白性、酸性、还原性和氧化性,读图可知,该实验用品红溶液检验是否有SO2生成,若品红溶液褪色或变浅,说明装置A中反应产生的气体含有SO2;(2)氢气具有强还原性,在加热条件下能使黑色的氧化铜还原为红色的单质铜,H2被氧化为能使白色的无水CuSO4固体变蓝的H2O,若装置E中黑色固体变为红色,F中白色粉末变为蓝色,说明装置A中放出的气体中含有H2;(3)常温下铁被浓硫酸钝化,表面有一层致密氧化物薄膜,加热下强氧化性、强酸性的浓硫酸可以将铁氧化为铁盐,而过量的单质铁可以将铁盐还原为亚铁盐,因此反应后A的溶液中铁元素可能既有Fe2+又有Fe3+,也可能只有Fe3+,还可能只有Fe2+,根据已知假设1、假设2的信息推断假设3为溶液中铁元素只有Fe2+;根据铁及其化合物的性质可知,Fe2+具有还原性,能使酸性KMnO4溶液褪色,Fe3+具有氧化性,能将KI溶液还原为能使淀粉溶液变蓝的I2,Fe2+遇KSCN溶液不变红,而Fe3+遇KSCN溶液变红,大量含有Fe3+的溶液呈黄色,与溴水的颜色相同,由此可以选择适当的试剂设计实验方案验证A的溶液中既有Fe2+又有Fe3+。
本题难度:一般
5、实验题 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,开始向试管中放入几小块镁片,再用滴管滴入5
mL盐酸于试管中。试回答下列问题:
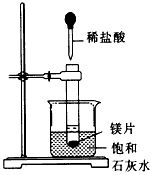
(1)实验中观察到的现象是____________________。
(2)产生上述现象的原因是____________________。
(3)写出有关的离子方程式____________________。
(4)由实验推知,MgCl2溶液和H2的总能量_______ (填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
参考答案:(1)①镁片溶解;②产生大量气泡;③饱和石灰水出现浑浊
(2)镁和盐酸反应使镁溶解且放出氢气,反应放出的热使饱和石灰水的温度升高,Ca(OH)2溶解度降低而析出固体,使溶液面浑浊
(3)Mg+2H+==Mg2++H2↑
(4)小于
本题解析:
本题难度:一般