1、实验题 (6分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH+6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”)。
(2)滴定结果如下表所示:
滴定
次数
| 待测溶液的体积/mL
| 标准溶液的体积
|
滴定前刻度/mL
| 滴定后刻度/mL
|
1
| 25.00
| 1.02
| 21.03
|
2
| 25.00
| 2.00
| 21.99
|
3
| 25.00
| 0.20
| 20.20
|
若NaOH标准溶液的浓度为0.1010 mol/L,则该样品中氮的质量分数为________。
参考答案:(6分,每空2分) ①偏高 ②无影响 (2)18.85%
本题解析:略
本题难度:一般
2、填空题 氯离子插层镁铝水滑石[Mg2Al(OH)6Cl?xH2O]是一种新型离子交换材料,其在高温下完全分解为MgO、 Al2O3、HCl和水蒸气,现用如图装置进行实验确定其化学式(固定装置略去)。

(1)Mg2Al(OH)6Cl?xH2O热分解的化学方程式为?。
(2)若只通过测定装置C、D的增重来确定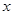 ,则装置的连接顺序为?(按气流方向,用接口字母表示),其中C的作用是?。装置连接后,首先要进行的操作名称是?。
,则装置的连接顺序为?(按气流方向,用接口字母表示),其中C的作用是?。装置连接后,首先要进行的操作名称是?。
(3)加热前先通过N2排尽装置中的空气,反应完成后,再持续通入N2的作用是?。
(4)完全分解后测得C增重3.65g、D增重9.90g,则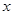 =?.
=?.
参考答案: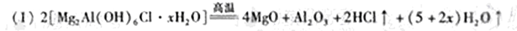
(2)a-c-d-b,吸收HCl气体,检查气密性
(3)将分解产生的气体全部带入装置C、D中完全吸收,防止倒吸
(4)3
本题解析:(1)根据题给信息:高温下完全分解为MgO、 Al2O3、HCl和水蒸气,可写出其化学方程式: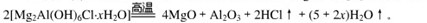
(2)装置C的作用是吸收反应生成的HCl气体,装置D的作用是吸收水蒸气,应该首先通过D装置吸收水蒸气,后通过C装置吸收HCl;将气体通过洗气瓶进行洗气时,应该从长导管一侧通入气体,故其连接顺序是a-c-d-b;连接好装置后首先应该检查装置的气密性。
(3)因为加热后的装置中含有残留的HCl和水蒸气,为了避免引起实验误差,保证反应产生的气体全部被装置C、D吸收,所以要通入N2排出装置内残留的气体,同时也是为了防止产生倒吸。
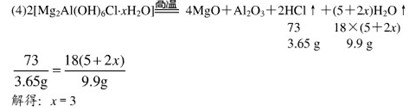
点评:本题考查化学方程式的书写,主要考查对实验装置和实验流程的理解和熟悉实验操作,同时通过计算,确定水分子数。综合性较强,题目难度较大。
本题难度:一般
3、实验题 (15分)某化学研究小组探究无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解的产物,并对所得气体产物和固体产物进行验证,按下图装置进行实验(夹持仪器已略去)。

(1)连接好装置后,加入药品前,应该进行的实验操作是________________(填操作名称)。
(2)实验开始时缓缓通入氮气,过一段时间以后,加热反应管A和E ,待反应完全后,停止加热,仍继续通氮气,直到反应管冷却。停止加热前是否需要先断开A、B的连接处和E、F的连接处?为什么?_______________________________________________________________。
(3)实验中观察到B中澄清石灰水变浑浊,则说明气体产物中有?(写化学式)。
能证明分解产物中有CO气体生成的实验现象是?。
(4)该小组同学查阅资料后得知,固体产物中不存在+3价Fe元素,而盐类物质只有K2CO3。
① 验证固体产物中钾元素存在的方法是?,现象是?。
② 研究小组为探究铁元素的存在形式,取A中充分反应后所得固体于试管中,加入足量蒸馏水,过滤、洗涤、干燥得到黑色粉末,取4.4g黑色粉末溶于足量稀硝酸中,收集到标准状况下NO气体1.12L通过计算判断黑色粉末的成分为?(写化学式)。写出黑色粉末溶于足量稀硝酸发生反应的离子方程式?。
参考答案:(1)检查装置的气密性(1分)
(2)不需要(1分)?因为N2不断通入,B、F瓶溶液不会倒吸。(1分)
(3)CO2(1分)? E中黑色固体变成红色,F中溶液变浑浊(2分)?
(4)①焰色反应(2分)?透过蓝色的钴玻璃观察到紫色火焰(1分)
②FeO 和Fe? 3FeO +10H+ +NO3-=3Fe3++NO↑+5H2O?
Fe+4H+ +NO3-=Fe3++NO↑+2H2O?(每空2分)
本题解析:(1)连接好装置后,加入药品前,应该进行的实验操作是必须检验装置的气密性。
(2)由于氮气持续的不断通入,而氮气是不溶于水的,所以不会造成溶液的倒吸,因此没有必要断开A、B的连接处和E、F的连接处。
(3)因为CO2能使澄清的石灰水变混浊,所以如果实验中观察到B中澄清石灰水变浑浊,则说明气体产物中有CO2。CO具有还原性,能把氧化铜还原生成红色的铜,而CO则被氧化生成CO2,CO2能使澄清的石灰水变混浊,据此可以判断。
(4)①检验钾元素常用焰色反应,但观察钾元素的焰色反应需要透过蓝色的钴玻璃观察。
②NO的物质的量是0.05mol,则转移电子是0.05mol×3=0.15mol。如果是铁,则铁是0.05mol,
质量是0.05mol×56g/mol=2.8g。如果是氧化亚铁,则其物质的量是0.15mol,质量是0.15mol
×72g/mol=10.8g。由于物质总共是4.4g,所以应该是FeO 和Fe的混合物。和硝酸反应的方程
式为3FeO +10H+ +NO3-=3Fe3++NO↑+5H2O、Fe+4H+ +NO3-=Fe3++NO↑+2H2O。
本题难度:一般
4、选择题 下列对比实验,得到的实验结论正确的是( )
| 实验方案
实验结论
实验1
实验2
A
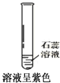
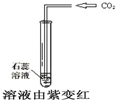
CO2能使紫色石蕊变红
B
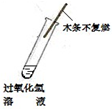
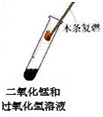
二氧化锰是过氧化氢分解的催化剂
C
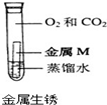
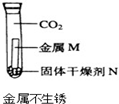
金属M生锈需要氧气
D

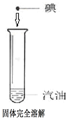
碘在水和汽油中的溶解性不同
|
A.A
B.B
C.C
D.D
参考答案:A、石蕊试液是酸碱指示剂,二氧化碳是酸性氧化物溶于水生成碳酸,使石蕊试液变红的是碳酸不是二氧化碳,故A错误;
B、带火星的木条迅速复燃,说明了二氧化锰加快了过氧化氢的分解速度;催化剂的作用是加快了反应的速度,并不能使不反应的物质发生反应,故B错误;
C、图示实验说明铁在无水、无氧气状态不易生锈,故C错误;
D、碘在水中和汽油中的溶解性不同,依据相似相溶,碘单质为非极性分子易溶解到非极性溶剂中,而水是极性溶剂,故D正确;
故选D.
本题解析:
本题难度:简单
5、实验题 &n bsp;小军在实验室里做了下列实验:
①分别向盛有稀硫酸和稀盐酸的试管中,滴加紫色石蕊试液;②向盛有稀硫酸的试管中,滴加氢氧化钠试液;③向盛有锌粒的试营中,分别滴加稀盐酸和稀硫酸;④将一根生锈的铁钉分别放入盛有稀盐酸和稀硫酸的试管中,过一会儿取出。
他在纸上记录了以下现象:
a. 溶液没有明显现象;b. 溶液变为黄色;c. 溶液显红色;d. 产生气泡,溶液无色。
下面请你来整理完成实验报告。
(1)实验目的:探究__________(填写物质类别)的化学性质。
(2)实验现象:产生a现象的实验所对应的一类反应通常被我们称作__________反应(该反应属于复分解反应)。
(3)上题所涉及的这类反应在日常生活和工农业生产中有广泛的应用。请举出一个利用该反应的实例:______________________________。
参考答案:(1)酸?(2)中和?(3)用熟石灰改变酸性土壤
本题解析:(1)酸的通性包括与指示剂作用、与碱反应、与活泼金属反应、与碱性氧化物反应等,恰好与小军设计的实验相对应,因此,小军设计该实验的目的是探究酸的性质。(2)上述实验与现象的对应关系是:①——c;②——a;③——d;④——b。(3)中和反应不仅在中学化学中是一类非常重要的反应,在日常生活和工农业生产中也有广泛的应用,如用熟石灰改变酸性土壤、用废碱中和工业污水中的酸等。
本题难度:简单