萃取
参考答案:B
本题解析:A中苯酚能和溴水反应生成三溴苯酚白色沉淀,但该物质能溶解在苯中,A不正确,应该用氢氧化钠溶液;甲烷不溶于水,甲醛易溶于水,B正确;乙酸乙酯和氢氧化钠溶液也反应,C不正确,应该有饱和的碳酸钠溶液。D中是渗析,不是萃取,答案选B。
点评:在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
本题难度:一般
2、选择题 分离下列各组混合物时,可以按溶解、过滤、蒸发的顺序操作的是(?)
A.氢氧化钠和氯化钠
B.氧化铜和铜粉
C.碳酸钠和碳酸钙
D.氯化钡和硝酸钡
参考答案:C
本题解析:略
本题难度:一般
3、填空题 某科研小组以难溶性钾长石(K2O?Al2O3?6SiO2)为原料,提取A12O3、 K2CO3等物质,工艺流程如下:
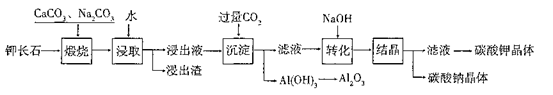
(1)“煅烧”过程中有如下反应发生:
①钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的化学方程式_____________________。
②钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和 KAlO2,写出Al2O3转化为NaAlO2的化学方程式____________________________。
(2)已知NaAlO2和KAlO2易发生如下反应:AlO2-+2H2O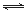 Al(OH)3+OH-。 Al(OH)3+OH-。
“浸取”时,应保持溶液呈______性(填“酸”或“碱”)。“浸取”时不断搅拌的目的是______________。
(3)“转化”时加入NaOH的主要作用是_______ (用离子方程式表示)。
(4)上述工艺中可以循环利用的主要物质是_______、_______和水。
参考答案:(1)①CaCO3+SiO2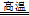 CaSiO3+CO2↑?(3分) CaSiO3+CO2↑?(3分)
②Na2CO3+Al2O3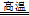 2NaAlO2+CO2↑?(3分) 2NaAlO2+CO2↑?(3分)
3? CuCl? FeCl2(3分)?
② Cl-+ CuCl = [CuCl2]-(2分)
③ 4FeCO3 + O2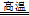 4CO2 + 2Fe2O3(3分) 4CO2 + 2Fe2O3(3分)
④ CuCl2、 NaCl (4分)
(2)(共4分)不会产生SO2污染大气(2分),不用煅烧黄铜矿从而节约热能 [或可得副产品铁红和硫,合理答案都行。2分]
本题解析:(1)①读图可知,缺少的生成物为FeCl2、CuCl,硫元素由—2升为0,设CuFeS2的系数为1,则2个硫原子升高总数为4,铜元素由+2降为+1,1个铜原子降低数为1,由于升降总数相等,则铁元素由+3降为+2,需要3个铁原子降低总数3,则CuFeS2+3FeCl3=CuCl+4FeCl2+2S;②依题意,难溶的CuCl与可溶的NaCl在水中发生反应,其原理为Cl-+ CuCl = [CuCl2]-;③依题意,该反应的反应物是FeCO3和O2,生成物是Fe2O3和CO2,铁元素由+2升为+3价,氧元素由0降为—2价,根据最小公倍数法配平可得:4FeCO3 + O2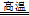 4CO2 + 2Fe2O3;依题意,Na[CuCl2]在水中发生反应V,铜元素由+1部分升高为+2,部分降低为0,则溶液A中含有Cl-、Cu2+和Na+,所以推断A的溶质主要是CuCl2和NaCl;(2)传统方法需要高温煅烧,不仅消耗大量的能量,而且还产生大量的SO2等有毒气体,污染空气,新方法的优点是不会产生SO2污染大气,不用煅烧黄铜矿从而节约热能,可得副产品铁红和硫。 4CO2 + 2Fe2O3;依题意,Na[CuCl2]在水中发生反应V,铜元素由+1部分升高为+2,部分降低为0,则溶液A中含有Cl-、Cu2+和Na+,所以推断A的溶质主要是CuCl2和NaCl;(2)传统方法需要高温煅烧,不仅消耗大量的能量,而且还产生大量的SO2等有毒气体,污染空气,新方法的优点是不会产生SO2污染大气,不用煅烧黄铜矿从而节约热能,可得副产品铁红和硫。
本题难度:一般
4、填空题 (8分)某白色粉末A常在果园里用作杀菌剂,现进行下列实验:?①白色粉末溶解在水中,得到蓝色溶液;②往蓝色溶液中加入适量的盐溶液B,恰好沉淀完全,过滤,得到白色沉淀和蓝色溶液;③往蓝色溶液中加入适量C溶液,恰好沉淀完全,过滤,得到蓝色沉淀和纯净的硝酸钾溶液。
(1)根据实验现象推断 A.?,B.?,C.?。
(2)写出操作②所发生反应的化学方程式:?。
参考答案:(8分) (1)A.CuSO4,B.Ba(NO3)2,C.KOH 。
(2)? CuSO4+ Ba(NO3)2= BaSO4↓+Cu(NO3)2
本题解析:由①知:白色粉末A、溶解在水中得到蓝色溶液、用作杀菌剂可综合判定A为CuSO4;由③得:蓝色溶液+C溶液→蓝色沉淀Cu(OH)2↓+KNO3,可知蓝色溶液为Cu(NO3)2溶液,C为KOH
由②得:CuSO4溶液+盐B溶液→白色沉淀↓+Cu(NO3)2溶液,可知B为Ba(NO3)2
(1)A.CuSO4,B.Ba(NO3)2,C.KOH
(2)CuSO4+ Ba(NO3)2= BaSO4↓+Cu(NO3)2
本题难度:一般
5、选择题 一定量的Zn与一定浓度的H2SO4反应,生成气体在标准状况下体积为2.24L。下列关于反应消耗的H2SO4的物质的量的推测肯定正确的是
A.n(H2SO4)=0.1mol
B.n(H2SO4)=0.2mol
C.0.1molD.0.1mol≤n(H2SO4)≤0.2mol
参考答案:D
本题解析:一定量的Zn与一定浓度的H2SO4反应,生成气体可能是氢气、也可能是二氧化硫、还可能是二者的混合物。气体为0.1mol。?如是二氧化硫,则硫酸物质的量为0.2mol;?如是氢气,则二氧化硫物质的量为0.1mol;?如是二者的混合物,则硫酸:0.1mol≤n(H2SO4)≤0.2mol。
点评:考查金属和酸的反应,注意整个过程中酸的被稀释问题。
本题难度:一般
|