1、选择题 对于下列化学事实的表述中,有错误的是
A.浓硝酸需要在棕色瓶中保存,以防止硝酸见光分解
B.向Fe(OH)3胶体中逐滴滴入过量的稀硫酸,能发生“先沉淀后溶解”的现象
C.向石蕊试液中滴加氯水溶液先变红后褪色
D.向无色溶液中滴加盐酸生成能使澄清石灰水变浑浊的无色气体,证明溶液一定含CO32-
参考答案:D
本题解析:分析:A.浓硝酸不稳定,见光分解;
B.根据胶体的性质,加入稀硫酸产生聚沉现象,随后H2SO4与Fe(OH)3反应;
C.Cl2通入溶液生成盐酸和次氯酸,盐酸具有酸性,次氯酸具有漂白性;
D.能使澄清石灰水变浑浊的无色气体有CO2、SO2等;
解答:A.浓硝酸不稳定,见光分解,需要在棕色瓶中保存,故A正确;
B.根据胶体的性质,加入稀硫酸产生聚沉现象,随后H2SO4与Fe(OH)3反应,所以发生“先沉淀后溶解”的现象,故B正确;
C.Cl2通入溶液生成盐酸和次氯酸,盐酸具有酸性,石蕊试液变红,次氯酸具有漂白性,溶液红色褪去,故C正确;
D.向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体,气体可能为二氧化硫或二氧化碳,则溶液中可能存在HCO3-、SO32-、HSO3-、CO32-,故D错误;
故选:D;
点评:本题主要考查的是物质的性质,物质的性质决定了用途和保存方法,需要注意的是胶体的性质,如聚沉.
本题难度:困难
2、选择题 设NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,11.2?L氧气所含的氧原子数为NA
B.标准状况下,11.2?L?S03中含1.5NA个氧原子
C.1.8g重水(D20)中含0.9NA个中子
D.10g氖气中所含的原子数为NA
参考答案:C
本题解析:分析:A.常温常压下,气体摩尔体积不是22.4L/mol;
B.标准状况下,SO3是固体;
C.根据n=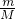 计算1.8g重水(D2O)的物质的量,每个D2O分子中含有10个中子,据此计算中子物质的量,再根据N=nNA计算中子数目;
计算1.8g重水(D2O)的物质的量,每个D2O分子中含有10个中子,据此计算中子物质的量,再根据N=nNA计算中子数目;
D.根据n=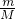 计算10g氖气的物质的量,氖气是单原子分子,再根据N=nNA计算氖原子数目.
计算10g氖气的物质的量,氖气是单原子分子,再根据N=nNA计算氖原子数目.
解答:A.常温常压下,气体摩尔体积不是22.4L/mol,由pV=nRT可知,气体摩尔体积大于22.4L/mol,11.2?L氧气的物质的量小于0.5mol,所含的氧原子数小于NA,故A错误;
B.标准状况下,SO3是固体,不能利用气体摩尔体积计算其物质的量,11.2LS03的物质的量远远大于0.5mol,故B错误;
C.1.8 g重水(D2O)的物质的量为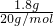 =0.09mol,每个D2O分子中含有10个中子,含有中子物质的量为0.09mol×10=0.9mol,含有中子数目为0.9mol×NAmol-1=0.9NA,故C正确;
=0.09mol,每个D2O分子中含有10个中子,含有中子物质的量为0.09mol×10=0.9mol,含有中子数目为0.9mol×NAmol-1=0.9NA,故C正确;
D.10g氖气的物质的量为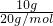 =0.5mol,氖气是单原子分子,故含有氖原子数目为0.5mol×1×NAmol-1=0.5NA,故D错误;
=0.5mol,氖气是单原子分子,故含有氖原子数目为0.5mol×1×NAmol-1=0.5NA,故D错误;
故选C.
点评:本题考查常用化学计量的有关计算,难度不大,注意气体摩尔体积的使用条件与对象,注意标准状况下,SO3是固体.
本题难度:困难
3、选择题 现有一瓶甲、乙的混合物,已知甲、乙属同系物,甲、乙某些性质如下:
A.蒸馏
B.萃取
C.加热升华
D.分液
参考答案:A
本题解析:分析:互溶且沸点不同的液体采用蒸馏的方法分离.
解答:根据题中信息可以看出,甲和乙两物质的熔点相差不大,均易溶于水,能互溶,但是沸点相差较大,所以可以采用蒸馏的方法通过控制沸点的不同来实现二者的分离,故选A.
点评:本题考查物质的分离、提纯的基本方法选择与应用,难度不大,熟记常见物质的分离方法和原理是解题的关键所在.
本题难度:简单
4、选择题 下列情况发生了化学变化的是
A.常温下铝与浓硝酸
B.常温下镁与乙醇
C.常温下液氯与铁
D.加热时氧化钙与氢气
参考答案:AB
本题解析:分析:根据化学变化是指原子核不变的情况下,有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别在于是否有新物质生成来分析.
解答:A、常温下铝与浓硝酸发生了钝化,在金属的表面生成一层致密的金属氧化物,有新物质金属氧化物等生成,是化学变化,故A正确;
B、常温下镁与乙醇发生反应生成了乙醇镁和氢气,有新物质生成,属于化学变化,故B正确;
C、常温下液氯与铁不发生反应,没有新物质生成,也不是物理变化,故C错误;
D、加热时氧化钙与氢气不发生反应,没有新物质生成,也不是物理变化,故D错误;
故选AB.
点评:本题难度不大,解答时要分析变化过程中是否有新物质生成,同时要掌握物质间反应的条件.
本题难度:简单
5、选择题 下列有关溶液的说法中,正确的是
A.含H+的溶液显酸性,含OH-的溶液显碱性
B.用丁达尔现象实验可区分葡萄糖溶液和氢氧化铁胶体
C.某饱和溶液变成不饱和溶液,溶质的质量分数一定减小
D.标准状况下,2.24?L?NH3溶于水制得1L氨水,则c?(NH3?H2O)=0.1mol?L-1
参考答案:B
本题解析:分析:A.溶液的酸碱性取决于溶液中氢离子浓度与氢氧根离子浓度的相对大小;
B.胶体有丁达尔效应;
C.在不指明温度的情况下饱和与不饱和溶液溶质质量分数无法比较;
D.NH3?H2O是弱电解质.
解答:A.判断溶液的酸碱性应根据溶液中氢离子浓度与氢氧根离子浓度的相对大小判断,故A错误;
B.溶液无丁达尔效应,胶体有丁达尔效应,可用丁达尔效应可以区别溶液与胶体,故B正确;
C.在不指明温度的情况下饱和与不饱和溶液溶质质量分数无法比较大小,相同温度饱和溶液一定比不饱和溶液质量分数要大,故C错误;
D.NH3?H2O是弱电解质,能发生部分电离,浓度小于0.1mol?L-1,故D错误.
故选B.
点评:本题考查酸碱的定义、胶体的性质、饱和溶液、弱电解质的电离等,难度不大,注意溶液的酸碱性取决于溶液中氢离子浓度与氢氧根离子浓度的相对大小.
本题难度:一般