1、选择题 化学工作者从反应RH+Cl2(g)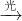 RCl(l)+HCl(g)受启发,提出在农药和有机合成工业中可获得副产品盐酸.这一设想已成为现实.试指出从上述反应产物中得到盐酸可能用到的最佳分离方法是
RCl(l)+HCl(g)受启发,提出在农药和有机合成工业中可获得副产品盐酸.这一设想已成为现实.试指出从上述反应产物中得到盐酸可能用到的最佳分离方法是
A.蒸馏法
B.水洗分液法
C.升华法
D.有机溶剂萃取法
参考答案:B
本题解析:分析:由反应RH+Cl2(g)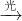 RCl(l)+HCl(g)可知,生成物为RCl和HCl,利用它们的溶解性来分析.
RCl(l)+HCl(g)可知,生成物为RCl和HCl,利用它们的溶解性来分析.
解答:因RCl不溶于水,而HCl易溶于水,可用水洗分液法分离,
故选B.
点评:本题考查学生物质分离的方法,熟记物质的性质是解题的关键所在,难度不大.
本题难度:简单
2、选择题 下列物质中不属于有机物的是
A.NaCN
B.CH3COOH
C.C2H2
D.CH2Cl2
参考答案:A
本题解析:分析:根据含有碳元素的化合物叫有机化合物,简称有机物;碳的氧化物、碳酸盐、碳酸虽含碳,但其性质与无机物类似,因此把它们看作无机物;据此进行分析判断.
解答:A.NaCN中虽然含有碳元素,但是碳酸的性质和无机物相似,属于无机物,故A正确;
B.乙醇是由碳、氢、氧三种元素组成的,是一种含碳的化合物,属于有机物,故B错误;
C.C2H2是含有碳元素的化合物,属于有机物,故C错误;
D.CH2Cl2是含有碳元素的化合物,属于有机物,故D错误.
故选A.
点评:本题考查有机物的概念,难度不大,掌握有机物与无机物的概念、特征等是正确解答此类题的关键.
本题难度:简单
3、选择题 NA表示阿伏加德罗常数的值,下列关于0.2mol/L K2SO4溶液的说法正确的是
A.1000mL水中所含K+、SO42-总数为0.3NA
B.500mL溶液中含有0.2NA个K+
C.1L溶液中K+的浓度为0.4mol/L
D.1L溶液中SO42-的浓度是0.4mol/L
参考答案:BC
本题解析:分析:A.根据n=cV计算硫酸钾的物质的量,每摩尔硫酸钾含有3mol离子(2mol钾离子,1mol硫酸根离子),再根据N=nNA计算离子的数目;
B.根据n=cV计算钾离子的物质的量,再根据N=nNA计算钾离子的数目;
C.每摩尔硫酸钾含有2mol钾离子,钾离子的浓度为硫酸钾的2倍;
D.溶液是均一的,每摩尔硫酸钾含有1mol硫酸根,硫酸根离子的浓度等于硫酸钾的浓度.
解答:A.1L溶液中所含K+、SO42-总数为1L×0.2mol/L×3×NAmol-1=0.6NA,故A错误;
B.500mL溶液中含有K+离子数为0.5L×0.4mol/L×NAmol-1=0.2NA,故B正确;
C.0.2mol/L?K2SO4溶液,每摩尔硫酸钾含有2mol钾离子,钾离子的浓度为硫酸钾的2倍,所以K+离子浓度是0.4mol/L,故C正确;
D.溶液是均一的,每摩尔硫酸钾含有1mol硫酸根,硫酸根离子的浓度等于硫酸钾的浓度为0.2mol/L,故D错误.
故选BC.
点评:本题考查阿伏加德罗常数,题目难度中等,注意注意溶液是均一的,浓度与体积无关.
本题难度:困难
4、选择题 含MgCl2、FeCl3、Al2(SO4)3三种溶质的混合溶液中,已知Cl-为1.5mol,Al3+和Fe3+共0.5mol,Mg2+为0.5mol,则SO42-的物质的量为
A.1mol
B.0.5mol
C.0.25mol
D.0.15mol
参考答案:B
本题解析:分析:令硫酸根的物质的量为n,根据溶液中阴阳离子所带的正负电荷总数相等,列式计算n值.据此判断.
解答:令硫酸根的物质的量为n,根据溶液中阴阳离子所带的正负电荷总数相等,则:
0.5mol×3+0.5mol×2=1.5mol×1+2n
解得:n=0.5mol.
故选:B.
点评:考查溶液物质的量浓度的计算,浓度不大,利用常规解法,比较麻烦,本题根据溶液不显电性阳离子与阴离子所带电荷总数相等,即电荷守恒原则解答,注意电荷守恒原则在混合溶液有关离子浓度计算经常运用.
本题难度:困难
5、选择题 标准状况下,5.6升NOx气体的质量是7.5克,则x的值为
A.1
B.2
C.3
D.4
参考答案:A
本题解析:分析:利用n=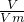 、n×M=m来计算,注意标准状况下为22.4L/mol来解答.
、n×M=m来计算,注意标准状况下为22.4L/mol来解答.
解答:标准状况下,5.6升NOx气体的物质的量为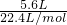 =0.25mol,
=0.25mol,
M=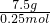 =30,
=30,
由相对分子质量与摩尔质量的数值相等,
则14+16×x=30,
解得x=1,
故选A.
点评:本题考查物质的量的有关计算,明确以物质的量为中心的计算公式即可解答,难度不大.
本题难度:一般