1、填空题 请按要求回答下列问题:
(1)铝热反应在工业生产中的重要用途之一是______;
(2)氯气是一种重要的化工原料,工业上用电解饱和食盐水制氯气,写出该反应的化学方程式______.
(3)镁带着火时,不能用液态CO2灭火剂来灭火的原因是(用化学方程式表示)______.
参考答案:(1)铝热法是一种利用铝的还原性获得高熔点金属单质的方法,重要用途之一是冶炼金属.故答案为:冶炼金属;
(2)电解饱和食盐水,Cl-在阳极放电生成氯气,水电离出的H+在阴极放电生成氢气,点解的总的化学方程式:2NaCl+2H2O电解.C12↑+H2↑+2NaOH,
故答案为:2NaCl+2H2O电解.C12↑+H2↑+2NaOH;
(3)镁带着火时,不能用液态CO2灭火剂来灭火,原因是镁带能在CO2中燃烧,生成氧化镁和碳,反应:2Mg+CO2点燃.2MgO+C.
故答案为:2Mg+CO2点燃.2MgO+C.
本题解析:
本题难度:一般
2、填空题 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒来源:91考试网 www.91exAm.org以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
(1)发生器中鼓入空气的作用可能是_________________。
(2)吸收塔内发生反应的化学方程式为________________________。
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是___________________。
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是________________________
参考答案:(1)稀释ClO2以防止爆炸
(2)2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2
(3)连续测定吸收塔内溶液的pH
(4)蒸发、冷却结晶、过滤
本题解析:
本题难度:一般
3、填空题 铝热剂是______和______的混合物.写出铝粉和氧化铁的混合物在高温下反应的化学方程式并标出电子转移方向和数目______.
铝热反应可用于______反应中铝表现出______.
参考答案:铝热剂为铝和金属氧化物的混合物,在高温条件下,铝和氧化铁发生氧化还原反应生成铁和氧化铝,电子转移的方向和数目可表示为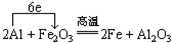 ,反应中铝为还原剂,并放出大量的热,可用于冶炼难熔金属,
,反应中铝为还原剂,并放出大量的热,可用于冶炼难熔金属,
故答案为:铝;某些金属氧化物;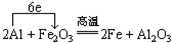 ;焊接钢轧、冶炼难熔金属;还原性.
;焊接钢轧、冶炼难熔金属;还原性.
本题解析:
本题难度:简单
4、填空题 氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下
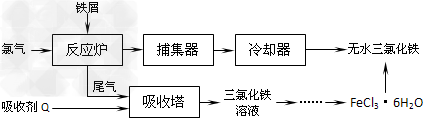
(1)试写出吸收塔中反应的离子方程式:___________________________。
(2)六水合氯化铁在水中的溶解度如下
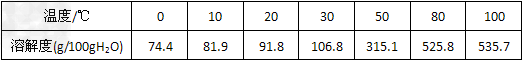
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、___________、_________、过滤、洗涤、干燥。
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=__________。(常温下Ksp[Fe(OH)3]=2.6×10-39)。
(4)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用c?mol·L-1?Na2S2O3溶液滴定用去V?mL。(已知:I2+2S2O32-=2I-+S4O62-)
①?滴定终点的现象是:____________________?。
②?求样品中氯化铁的质量分数(写出计算过程)。
参考答案:(1)2Fe2+?+?Cl2=?2Fe3+?+?2Cl-
(2)蒸发浓缩;冷却结晶
(3)2.6×10-9?mol·L-1
(4)①?滴入最后一滴,溶液颜色由蓝色变为无色,且半分钟内不变色;②?1.625Vc/m×100%
本题解析:
本题难度:一般
5、填空题 碳酸锂广泛应用于陶瓷和医药等领域。以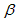 -锂辉石(主要成分为Li2O·Al2O3·4SiO2)为原材料制备
-锂辉石(主要成分为Li2O·Al2O3·4SiO2)为原材料制备
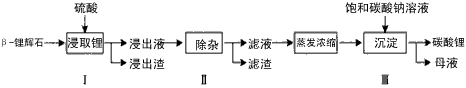
Li2CO3的工艺流程如下
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、5.2、9.7和
12.4;Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g.
(1)步骤Ⅰ前,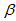 -锂辉石要粉碎成细颗粒的目的是_____________。
-锂辉石要粉碎成细颗粒的目的是_____________。
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、
Na+等杂质,需在搅拌下加入_____________(填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的PH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有______________。
(4)步骤Ⅲ中,生成沉淀的离子方程式为________________。
(5)从母液中可回收的主要物质是_____________。
参考答案:(1)加快反应速率
(2)石灰石
(3)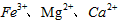
(4)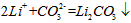
(5)NaOH
本题解析:
本题难度:困难