1、填空题 明矾石的主要成分是K2SO4·Al2(SO4)3·2Al?2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:?
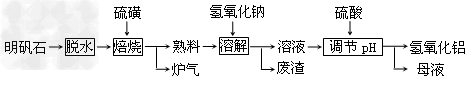
(1)“焙烧”过程中反应的化学方程式为2Al2(SO4)3+3S 2Al2O3?+_________;该反应的氧化剂是________;该反应中被氧化的元素与被还原的元素的质量比是________?。
2Al2O3?+_________;该反应的氧化剂是________;该反应中被氧化的元素与被还原的元素的质量比是________?。
(2)“溶解”时反应的离子方程式为____________。
(3)“调节pH后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是_____________。
(4)“母液”中可回收的物质是_____________。
(5)工业上常用氢氧化铝脱水后的产物X熔融电解冶炼金属铝,则该反应的化学方程式为_______________。
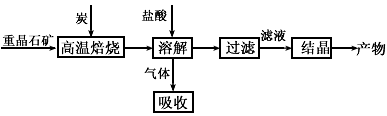
2、填空题 工业上制备BaCl2的工艺流程图如下图某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。
查表得:
BaSO4(s)+4C(s) 4CO(g)+ BaS(s) △H1=+571.2kJ ·mol-1 ①
4CO(g)+ BaS(s) △H1=+571.2kJ ·mol-1 ①
BaSO4(s)+2C(s) 2CO2(g)+BaS(s) △H2 =+ 226. 2kJ·mol-1 ②
2CO2(g)+BaS(s) △H2 =+ 226. 2kJ·mol-1 ②
(1)气体用过量的NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为_________。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时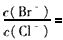 ____________. [ Ksp ( AgBr) = 5.4×10-13 ,Ksp ( AgCl) = 2. 0×10 -10 ]
____________. [ Ksp ( AgBr) = 5.4×10-13 ,Ksp ( AgCl) = 2. 0×10 -10 ]
(3)反应C(s) +CO2(g) 2CO( g)的△H=__________kJ·mol-1。
2CO( g)的△H=__________kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是_________。
3、填空题 汽车工业是世界上仅次于石油化工的第二大产业,传统汽车不仅消耗大量的石油资源,而且造成了严重的大气污染,汽车工业正积极寻求新的动力源,燃料电池有可能取代内燃机成为新一代汽车的动力。下图是一种甲醇制氢质子交换膜(PEMFC)燃料电池的工作示意图:甲醇制氢气的主要途径有:
①CH3OH(g)+H2O(g)==3H2 (g)+CO2 (g) △H= +49. 0kJ·mol-1
②CH3OH(g)+1/2O2(g)==2H2(g)+CO2(g) △H= -192. 9kJ·mol-1。
请回答下列问题:
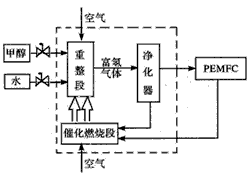
(1)反应①为___(填“放”或“吸”)热反应。
(2)催化重整段中把两种甲醇制取氢气的方法联合起来制氢,其目的是____(写出一条即可)。
(3)PEMFC工作时所产生的尾气(主要成分为H2)可循环应用于催化燃烧供热,则H2燃烧生成气态水时反 应的热化学方程式为____。
(4)甲醇制氢质子交换膜燃料电池取代内燃机成为新一代汽车的动力,其优点有___(填字母编号)。 A.减少氮氧化物的排放
B.减少SO2的排放
C.降低对石油等化石燃料的依赖性
D.能量利用率高
4、填空题 以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下
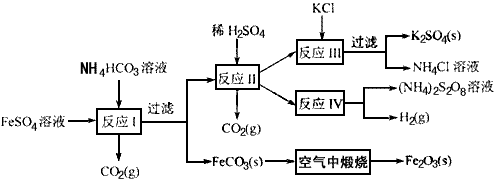
(1)反应I前需在 溶液中加入_________(填字母),以除去溶液中的
溶液中加入_________(填字母),以除去溶液中的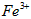 。
。
A.锌粉 B.铁屑 C.KI溶液 D.H2
(2)反应Ⅰ需控制反应温度低于35℃,其目的是_______________。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是_______________。
(4)反应Ⅳ常被用于电解生产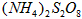 (过二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为________________________。
(过二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为________________________。
5、填空题 二氧化锰是制造锌锰干电池的基本原料,普通锌锰干电池的电池反应式为:2MnO2+Zn+2H2O=2MnOOH+Zn(OH)2。工业上以软锰矿为原料,利用硫酸亚铁制备高纯度二氧化锰的流程如下(软锰矿中所有金属元素在酸性条件下均以阳离子形式存在)
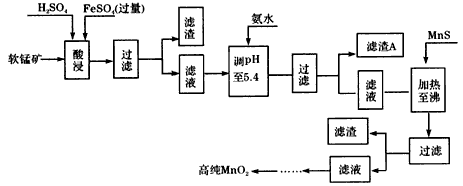
某软锰矿的主要成分为MnO2,还含Si(16. 27%)、Fe(5. 86%)、Al(3. 24%)、Zn (2.68%)和Cu(0. 86%)等元素的化合物。部分阳离子以氢氧化物形式完全沉淀时,溶液的pH及部分硫化物的Ksp(均为25℃时)见下表,回答下列问题
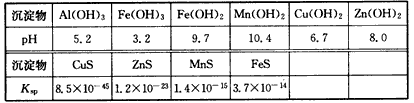
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要化学方程式为_________________。
(2)滤渣A的主要成分为__________。
(3)加入MnS的目的是除去__________杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应式为_______________。
(5)从废旧碱性锌锰电池中可回收利用的物质有_______________(写两种)。