1、选择题 下列关于σ键和π键的理解不正确的是( ? )
A.σ键能单独形成,而π键一定不能单独形成
B.σ键可以绕键轴旋转,π键一定不能绕键轴旋转
C.双键中一定有一个σ键、一个π键,三键中一定有一个σ键、两个π键
D.气体单质中一定存在σ键,可能存在π键
参考答案:D
本题解析:
本题难度:简单
2、填空题 金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)写出Ti基态原子的电子排布?。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C?B(选填“>”“<”),第一电离能N>O,原因是?。
(3)月球岩石玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为?,其中硫原子采用?杂化,氧原子的价电子排布图为?,任意写出一种SO42-等电子体?。
(4)将TiOSO4的稀溶液加热水解后,经进一步反应,可得到钛的某种氧化物。该氧化物的晶胞结构图如图所示。
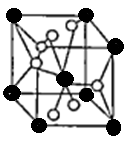
则该氧化物的化学式?(图中钛原子用“O”表示。氧原子用“O”表示)
参考答案:(1)1s22s22p63s23p63d24s2
(2)>? N原子2p上处于半充满状态,比较稳定,所以第一电离能N>O
(3)正四面体;sp3?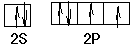 ?CCl4或ClO4-或S2O32-或PO43-
?CCl4或ClO4-或S2O32-或PO43-
(4)TiO2
本题解析:(1)Ti是22元素,核外电子排布式是1s22s22p63s23p63d24s2
(2)非金属性越强,电负性越大,所以电负性C大于B;N原子2p上处于半充满状态,比较稳定,所以第一电离能N>O;
(3)SO42-是AB4型,原子的孤对电子对数是(6+2-4×2)/2=0,所以立体构型是正四面体,采取sp3杂化;氧原子价电子是6,其价电子排布图是, ,与SO42-互为等电子体是5个原子,价电子数是32个,因而符合的有CCl4或ClO4-或S2O32-或PO43-;
,与SO42-互为等电子体是5个原子,价电子数是32个,因而符合的有CCl4或ClO4-或S2O32-或PO43-;
(4)O的个数是4×1/2+2=4,Ti的个数是8×1/8+1=2,该晶体的化学式为TiO2。
本题难度:一般
3、填空题 钾、镁、氟、硼等元素在每升海水中的含量都大于1毫克,属于海水中的常量元素。
(1)钾、镁、氟、硼电负性从大到小的排列顺序是__________________________。
(2)镓与硼同主族,写出镓元素原子的价电子排布式(即外围电子排布式):________________。
(3)用价层电子对互斥模型推断BF3和NF3的空间构型分别为________、________。
(4)钾、镁、氟形成的某化合物的晶体结构为K+在立方晶胞的中心,Mg2+在晶胞的8个顶角,F-处于晶胞的棱边中心。由钾、镁、氟形成的该化合物的化学式为________,每个K+与________个F-配位。
参考答案:(1)F>B>Mg>K
(2)4s24p1
(3)平面三角形 三角锥形
(4)KMgF3 12
本题解析:(1)同周期中,随着原子序数的递增,元素电负性增大;同主族中,随着原子序数的递增,元素电负性减小,而且一般情况下,非金属元素的电负性大于金属元素的电负性。
(2)镓为31号元素,位于第四周期,与B同主族,故最外层有3个电子,即价电子排布式为4s24p1。
(3)BF3的中心原子只有3个价电子,与3个F原子提供的3个电子形成3对成键电子,而NF3的中心原子N有5个价电子,与3个F原子提供的3个电子形成3对成键电子,还有1对孤电子对,故前者为平面三角形,后者为三角锥形。
(4)晶胞中的K+为1个,Mg2+为8×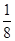 =1个,F-为12×
=1个,F-为12×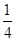 =3个,故钾、镁、氟形成的某化合物的化学式为KMgF3;晶胞12条棱上的12个F-与处于晶胞中心的K+等距离,所以每个K+与12个F-配位。
=3个,故钾、镁、氟形成的某化合物的化学式为KMgF3;晶胞12条棱上的12个F-与处于晶胞中心的K+等距离,所以每个K+与12个F-配位。
本题难度:一般
4、简答题 A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期主族元素.常温下A、B、C的常见单质均为无色、无味的气体,D、E的单质均为固体.C与E同主族,且E的原子序数为C的2倍,D的最外层电子数比最内层多1个,F是人体血红蛋白中含有的一种金属元素,请回答下列问题:
(1)D元素在周期表中的位置是:______周期______族.
(2)A与C形成的18电子分子的结构式为:______.
(3)最近意大利罗马大学的FunvioCacace等人获得了极具理论研究意义的B4分子.B4分子结构如图所示,已知断裂1mol B-B吸收167kJ热量,生成1mol B2放出942kJ热量.根据以上信息和数据,下列说法正确的是______.
A.B4沸点比P4(白磷)低,属于原子晶体
B.lmolB4气体转变为B2吸收882kJ热量
C.B4与B2互为同素异形体
D.B4与B2分子中各原子最外电子层均达到8电子稳定结构
(4)写出过量的F与稀硝酸反应的离子方程式______
(5)以D为阳极,在H2SO4溶液中电解,D表面形成氧化膜,阳极电极反应式为______.
(6)在常温,常压和光照条件下,B2在催化剂(TiO2)表面与A2C反应,生成1mol BA3(g)和C2时的能量变化值为382.5kJ,此反应BA3生成量与温度的实验数据如下表.则该反应的热化学方程式为______.
| T/K | 303 | 313 | 323
BA3生成量/(10-1mol)
4.3
5.9
6.0
|

参考答案:A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期主族元素.常温下A、B、C的常见单质均为无色、无味的气体,则A为H、B为N、C为O;E的原子序数为C的2倍,则E为S;D的最外层电子数比最内层多1个,最外层电子数为3,原子序数大于O元素,应处于第三周期,故D为Al;F是人体血红蛋白中含有的一种金属元素,则F为Fe,
(1)D为Al,原子核外有3个电子层,最外层电子数为3,处于第三周期第ⅢA族,
故答案为:第三、ⅢA族;
(2)H与O形成的18电子分子为H2O2,分子中O原子之间形成1对共用电子对、O原子与H原子之间形成1对共用电子对,故其结构式为:H-O-O-H,
故答案为:H-O-O-H;
(3)A.N4沸点比P4(白磷)低,属于分子晶体,故A错误;
B.1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1molN4气体转变为N2化学键断裂断裂吸收的热量为6×167kJ=1002kJ,形成化学键放出的热量为1884kJ,所以反应放热,放出的热量为1884kJ-1002kJ=882kJ,故B错误;
C.N4与N2是N元素形成的结构不同的单质,是同素异形体,故C正确;
D.N4与N2分子中各原子都形成3对共用电子对,且各有1对孤对电子,最外电子层均达到8电子稳定结构,故D正确,
故答案为:CD;
(4)过量的Fe与稀硝酸反应生成硝酸亚铁与NO、水,反应离子方程式为:
3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,
故答案为:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O;
(5)以Al为阳极,在H2SO4溶液中电解,Al表面形成氧化膜,Al在阳极失去电子生成氧化铝,需要有水参与反应,故同时生成氢离子,阳极电极反应式为为:2Al+3H2O-6e-═Al2O3+6H+,
故答案为:2Al+3H2O-6e-═Al2O3+6H+;
(6)在常温,常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,反应为2N2(g)+6H2O(l)═
4NH3(g)+3O2(g),由表中数据可知,温度越高生成的NH3越多,说明升高温度平衡向正反应方向移动,则正反应为吸热反应,生成1mol NH3(g),能量变化值为382.5kJ,则生成4molNH3吸收的热量=382.5kJ×4=1530kJ,则该反应的热化学方程式为:2N2(g)+6H2O(l)═4NH3(g)+3O2(g)△H=+1530kJ?mol-1,
故答案为:2N2(g)+6H2O(l)═4NH3(g)+3O2(g)△H=+1530kJ?mol-1.
本题解析:
本题难度:一般
5、选择题 下列物质只含共价键,不含离子键的是( ? )
A.Ca(OH)2
B.CO2
C.MgCl2
D.NH4Cl
参考答案:B
本题解析:
本题难度:简单