1、填空题 ①Cu、②NaOH、③I2、④MgCl2、⑤Na2O2、⑥Ar,回答下列问题。
(1)不存在化学键的是_________;
(2)存在金属键的是_________;
(3)只存在非极性键的是_________;
(4)只存在离子键的是_______;
(5)既存在离子键又存在极性键的是________;
(6)既存在离子键又存在非极性键的是________。
2、选择题 下列叙述正确的是
[? ]
A.原子晶体中,共价键的键能越大,熔沸点越高
B.分子晶体中,分子间作用力越大,该分子越稳定
C.金属阳离子只能与阴离子构成晶体
D.正四面体构型的分子中,键角一定为109°28′
3、选择题 我国将与德国合作,在近期启动钻探“可燃冰”的实物样品的工作,实现“可燃冰”钻探零的突破.“可燃冰”的主要成分是甲烷水合物[CH4?nH2O]晶体.有关甲烷水合物的说法正确的是( )
A.它属于原子晶体
B.它属于混合物
C.可燃冰可以燃烧说明水具有可燃性
D.甲烷水合物中H2O是极性分子,CH4是非极性分子
4、选择题 下列各项中表达正确的是( )
A.质量数为37的氯原子:
Cl
B.镁的原子结构示意图: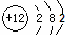
C.溴化银的化学式:AgBr2
D.NaOH在水中的电离方程式:NaOH=Na++O2-+H+
5、选择题 X、Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素阳离子半径;Z和Y两元素的原子最外层电子数相同,Z元素的原子半径大于Y 元素的原子半径,X、Y、Z三种元素原子序数的关系是( )
A.X>Y>Z
B.Y>X>Z
C.Z>X>Y
D.Z>Y>X